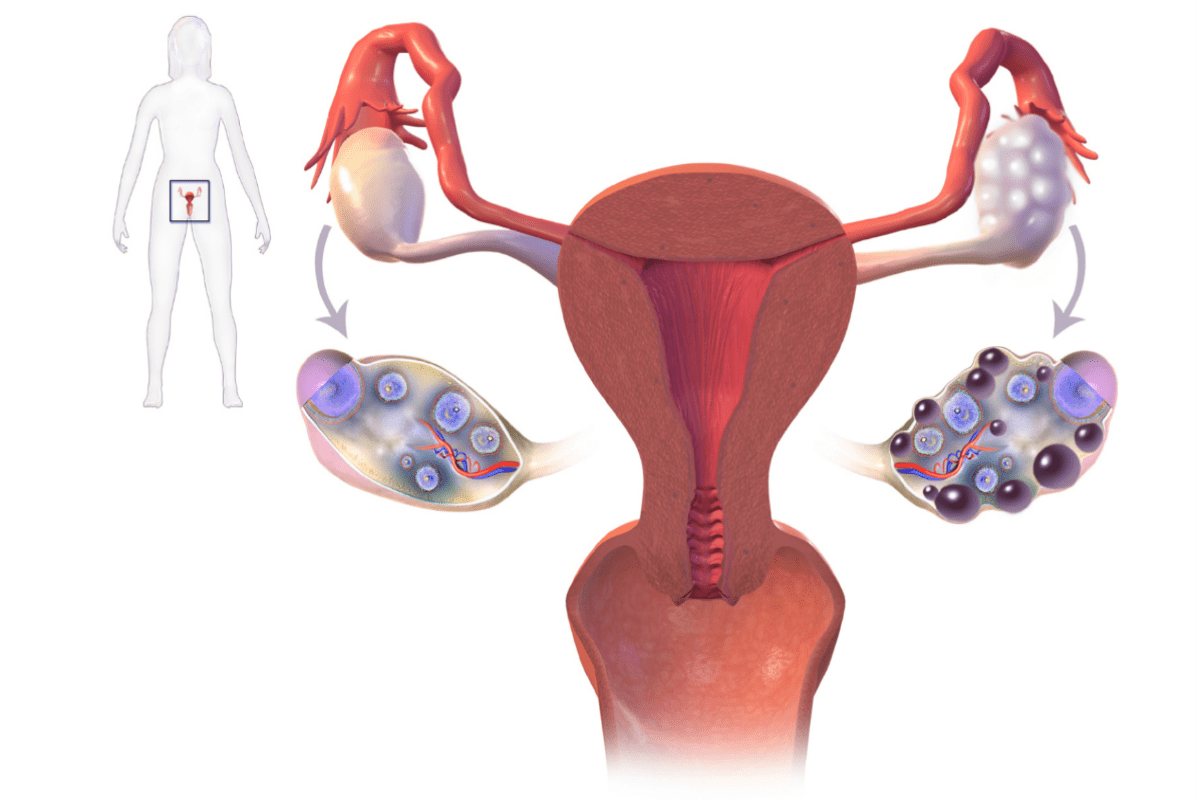
El Síndrome del Ovario Poliquístico (SOP) es considerado un tipo de Hiperandrogenismo Ovárico Funcional o Anovulación Crónica Hiperandrogénica (1-3) y la patología neuroendrocina más común en mujeres adultas no menopáusicas (1, 2, 4-6, 7-12).
¿Qué es el Síndrome del ovario poliquístico?
Stein y Leventhal (1935) (13) sentaron las bases para la descripción de éste síndrome, al describir una serie de signos en 7 pacientes que en el presente se consideran posibles manifestaciones del Síndrome del Ovario Poliquístico (tales como hirsutismo – crecimiento de vello corporal en mujeres con patrón masculino (14), ovarios poliquísticos, irregularidad menstrual, infertilidad…) (1, 4).
Se considera una disfunción endocrino-metabólica, (1) y una enfermedad multigénica compleja (1, 15).
Se trata de un síndrome (conjunto de síntomas/signos que caracterizan una patología) en el que la función ovárica está alterada y se asocia a hiperandrogenismo y/o presencia de ovario/s poliquísticos (2, 3) que no está limitado a la etapa reproductiva, también se han diagnosticado casos en etapa prepuberal y anterior (1).
Dentro de las alteraciones que pueden presentar las personas con Síndrome del Ovario Poliquístico, con mayor frecuencia se dan 3 interrelacionadas entre sí (1, 17, 18, 19):
- Disfunción neuroendocrina.
- Trastornos metabólicos.
- Disfunción de la esteroidogénesis y foliculogénisis.
Se da (entre otros) un aumento de secreción de LH (hormona que regula el ciclo menstrual y provoca la ovulación (20) y secreción normal o menor de FSH (hormona que colabora con la LH en la regulación del ciclo menstrual y favorece el crecimiento del óvulo (21).
Esto sumado a la elevada secreción de insulina, provocada por la resistencia a la insulina (RI) (principal trastorno metabólico de este síndrome), se produce un aumento de la producción andrógenos ováricos y suprarrenales, lo que en conjunto puede provocar la oligo-anovulación.
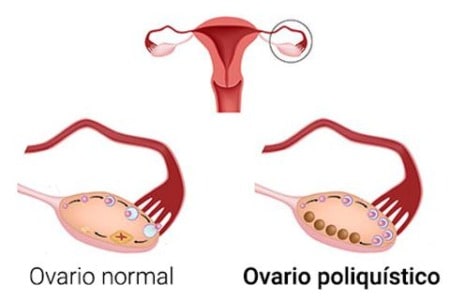
¿Cómo saber si tengo síndrome del ovario poliquístico?
A lo largo de los años se ha modificado tanto la definición, como los criterios para su diagnóstico del Síndrome del Ovario Poliquístico. De esta forma, se considera que una de sus primeras definiciones es la aportada a partir de los hallazgos de Stein y Leventhal (1935), (13) como una forma clínica que cursa trastornos menstruales, infertilidad, y alteraciones en la morfología de los ovarios (mayor tamaño múltiples micro-quistes).
Décadas después y durante mucho tiempo (incluso en la actualidad se sigue tomando como referencia), se aportó una nueva definición y se establecieron nuevos criterios de diagnóstico en el congreso de la National Institute of Health (NIH) en 1990, considerándose un tipo de hiperandrogenismo ajeno a otras enfermedades y asociado a anovulación crónica (1).
Sin embargo, en 2003, en el consenso celebrado en Rotterdam, se añadieron nuevos ítems tanto a la definición cómo a los criterios de diagnóstico, dando un espectro de fenotipos (conjunto de signos que caracterizan a un sujeto) más amplio (1, 23).
Bajo este nuevo consenso, el Síndrome del Ovario Poliquístico se considera “un síndrome de disfunción ovárica” (23) que se caracteriza por signos clínicos y/o fisiológicos de hiperandrogenismo (siendo descartadas otras causas del mismo), presencia de ovarios poliquísticos y/o irregularidades menstruales, al que se le asocian otras manifestaciones clínicas, como obesidad y resistencia a la insulina. También se le asocia un mayor riesgo de padecer patologías asociadas a dichas manifestaciones (1, 23).
En este congreso se propuso que para diagnosticar el Síndrome de Ovarios Poliquísticos, lo primero es descartar otras formas de hiperandrogenismo. Después de este descarte, se deberían cumplir 2 de 3 criterios (1, 4, 23):
- Hiperandrogenismo.
Conjunto de signos debidos al efecto incrementado de hormonas masculinas en la mujer (ya sea por aumento anómalo de su producción, alteraciones en su transporte o por una mayor sensibilidad a ellas) (24). - Oligo-anovulación.
Ovulación insuficiente o nula (25, 26). - Ovarios de apariencia poliquística en ecografía.
Desarrollo en zonas periférica y central del ovario de al menos 12 folículos antrales (quiste/bolsa en la que crece el óvulo, en dos posibles estadíos de maduración previa a la ovulación) de 2-9mm de diámetro (4, 27, 28, 29, 30).
De esta forma, aunque en sus mismas denominaciones y definición, se detalla que se trata de una patología que presenta hiperandrogenismo con presencia de ovarios poliquísticos, el presentar un cuadro cínico y/o fisiológico con únicamente una de estas características, no sería suficiente para diagnosticar el Síndrome del Ovario Poliquístico.
Bajo estos criterios se establecieron la existencia de 4 fenotipos del síndrome (una vez descartados otros posibles diagnósticos) (1, 2, 23), los cuales podrían ser diferentes grados del Síndrome del Ovario Poliquístico (2).
El aumento de los niveles de andrógenos (o parte de ellos) puede entrar en valores normales, pero, como se ha explicado y se expone con la existencia de los diferentes fenotipos del síndrome, esto no eximiría de su diagnóstico (1, 23).
Por otro lado, aunque actualmente estos criterios siguen siendo tenidos en cuenta para el diagnóstico, sigue habiendo controversia sobre si son adecuados o no para el diagnóstico de este síndrome (2, 31). Así, se celebró, por ejemplo, otro consenso en 2006 dónde se defendía que para el diagnóstico de este síndrome siempre debería estar presente el hiperandrogenismo (32, 33).
Hay que tener en cuenta que, en lo que no existe discusión actualmente es en que el Síndrome del Ovario Poliquístico es, como se ha citado anteriormente, una disfunción endocrino-metabólica multigénica compleja (1, 15), por lo que es comprensible que su diagnóstico sea complejo, difícil y por tanto discutido.
¿Qué causa el síndrome de ovarios poliquistico?
Se han propuesto varios factores por los que se desarrollaría el Síndrome del Ovario Poliquístico (desajustes hormonales, resistencia a la insulina -RI-…) (4). El aumento de la producción de andrógenos parece estar provocada por el aumento de la hiperinsulinemia (alta concentración de insulina en sangre, superior a los valores normales) (34, 2, 35).
Así, hiperandrogenismo y resistencia a la insulina se consideran muy relacionados entre sí y con la causa del síndrome (2, 3, 4, 35, 36). Pese a esto, su origen está aún por determinar (1, 4, 37), considerándose multifactorial (1, 4).
Ver esta publicación en Instagram
Certificación online sobre el SOP
Si te has quedado con ganas de más y deseas ampliar tu formación en el SOP, te recomendamos nuestra certificación online.
En esta certificación vamos a conocer en qué consiste el SOP, la prevalencia en la población y en base a qué criterios se diagnostica. Aprenderás paso a paso, cómo tratar el síndrome del ovario poliquístico y mejorarlo con la alimentación y qué aspectos tener en cuenta a la hora de entrenar.
Descubre cuáles son los factores de riesgo más importantes a tener en cuenta para prevenir la aparición del SOP.
En esta certificación vamos a aprender qué es el Síndrome de Ovario Poliquístico (SOP), cómo se manifiesta en la mujer y la importancia de un estilo de vida saludable en el manejo de los síntomas.
Aprende paso a paso, cómo tratar el síndrome del ovario poliquístico y mejorarlo con la alimentación y qué aspectos tener en cuenta a la hora de entrenar.
Epidemiología
El síndrome de ovarios poliquísticos se considera la patología neuro-endocrino-metabólica más común en mujeres en edad reproductiva y su prevalencia varía en diferentes poblaciones (1, 2, 4, 5, 6, 7, 8, 9, 10, 11, 12):
- 3-11,2% en mujeres de pubertad a 45 años (edad reproductiva).
En un menta-análisis (n=43 estudios) determinaron que, según los criterios de diagnóstico empleados, la prevalencia es del 6-10% [38]. - 72,1-82,02% de mujeres con hiperandrogenismo.
- 29-41% de mujeres con infertilidad.
- >75% en mujeres con hirsutismo.
- 30-42% en mujeres con obesidad.
Varía según país -30%España, 42%EEUU-). - +10% en mujeres en etapa pre-menopáusica.
Desde este artículo se recomienda cautela a la hora de asumir estos datos, ya que en su mayoría han sido obtenidos en años anteriores al 2003, y por tanto a partir de los criterios de la que se usaban desde 1990 hasta ese año, lo que muy probablemente haya excluido a las mujeres diagnosticadas con los criterios establecidos en el congreso de Rotterdam de 2003 (5, 6, 10, 11, 23).
Pese a esto, el Síndrome de Ovarios Poliquísticos se considera una de las alteraciones endocrino-metabólicas más frecuente e importante de las mujeres (1, 2, 4, 5, 6, 7, 39, 40).
Respecto a la prevalencia de cada fenotipo (criterios de Rotterdam 2003), según Carvajal et al (2010) (2), de las mujeres diagnosticadas de Síndrome del Ovario Poliquístico es la siguiente:
- Fenotipo A: 62%
- Fenotipo B: 21%
- Fenotipo C: 9%
- Fenotipo D: 8%
Síntomas del síndrome del ovario poliquístico
Como se ve en la Tabla 1, son muy variados, y presencia depende de cada persona y de la edad de la misma (1, 2, 12, 33, 36, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63):
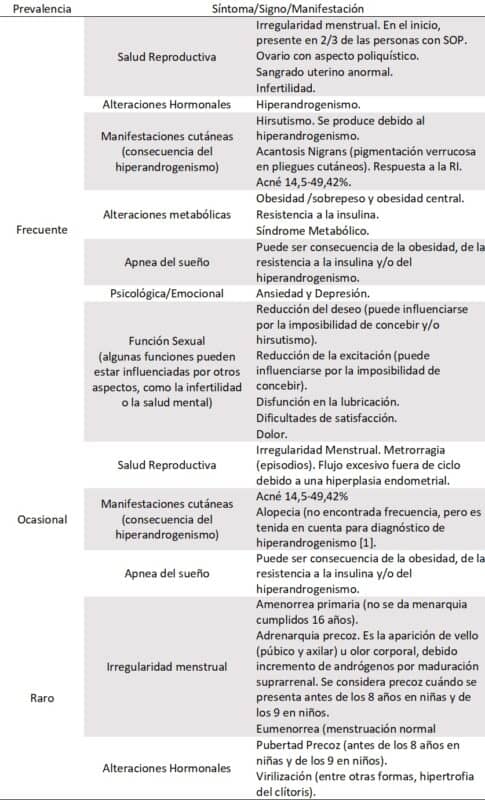
Cómo se puede observar en la Tabla 1, hay manifestaciones que son más frecuentes que otras. Esto puede deberse a la nacionalidad de la muestra y tamaño muestral de los diferentes estudios citados.
Normalmente estas manifestaciones se inician cerca del comienzo de la menarquia (1, 4, 39); (primera menstruación), y varían según la persona crece (1, 39, 47).
Por otro lado, la magnitud del riesgo de desarrollar estas patologías y/o disfunciones asociadas al síndrome de ovarios poliquísticos, también varía en función del fenotipo al que se pertenezca (2).
Riesgos a largo plazo
Debido principalmente al hiperandrogenismo y a la hiperinsulinemia, pero también a factores descritos anteriormente, las mujeres que padecen Síndrome del Ovario Poliquístico pueden tener mayor riesgo de desarrollar las siguientes patologías o sucesos (1, 2, 4, 15, 33, 36, 41, 42, 43, 47, 57, 58, 65, 66, 67, 68, 69, 70, 71, 72, 73):
- Diabetes Tipo 2.
- Intolerancia a la glucosa.
- Síndrome Metabólico.
- Dislipidemia.
- HTA.
- Infarto de miocardio.
- Angina.
- Enfermedad cardiovascular.
- Proceso inflamatorio crónico.
- Hígado graso no alcohólico.
- Cáncer de endometrio.
- Transmisión del Síndrome del Ovario Poliquístico (o rasgos del mismo) a la descendencia.
Síndrome del Ovario Poliquístico, dada su base genética, podría ser hereditaria y no excluyente al sexo femenino; se han encontrado en madres, hermanas (15, 66) y hermanos (65, 67) de mujeres con Síndrome del Ovario Poliquístico elevados niveles de andrógenos, así como resistencia a la insulina, o bien riesgo de padecerla, en padres, madres, hermanas y hermanos de mujeres con Síndrome del Ovario Poliquístico (15, 65, 66). Esto quiere decir que tanto madres y hermanas, como padres y hermanos, pueden desarrollar algún rasgo fenotípico del síndrome (1, 15, 65, 66, 67). - Alta tasa de abortos.
- Diabetes gestacional.
- Pre-eclampsia (trastorno que cursa HTA y daño en otros órganos -frecuentemente hígado y riñones).
- Ansiedad y Depresión.
Certificación online sobre el SOP
Si te has quedado con ganas de más y deseas ampliar tu formación en el SOP, te recomendamos nuestra certificación online.
En esta certificación vamos a conocer en qué consiste el SOP, la prevalencia en la población y en base a qué criterios se diagnostica. Aprenderás paso a paso, cómo tratar el síndrome del ovario poliquístico y mejorarlo con la alimentación y qué aspectos tener en cuenta a la hora de entrenar.
¿Cómo tratar el síndrome del ovario poliquístico?
El tratamiento, hasta lo que hoy se sabe, varía en función de la sintomatología (74, 75), debiendo estar en primer lugar orientado a atender y/o prevenir los trastornos metabólicos que se estén cursando y/o que se corren riesgo de padecer (1) (Tabla1).
Los demás objetivos del tratamiento son corregir o atenuar las alteraciones menstruales y hormonales que caracterizan al Síndrome del Ovario Poliquístico (1) que a su vez podría mejora otros aspectos del síndrome. Por ejemplo, el tratamiento de la obesidad/sobrepeso puede ayudar a prevenir que se produzcan abortos (71).
El tipo de tratamiento más común es el farmacológico debido a sus beneficios, pero que no están exentos de riesgos o contraindicaciones (1). El tratamiento no farmacológico más común y recomendado es la adopción inicial de hábitos saludables (dieta y ejercicio físico), sobre todo en casos de Síndrome del Ovario Poliquístico anovulatorios (1, 8, 33, 39, 51, 73, 76, 77). Incluso algunos autores afirman que la infertilidad puede tratarse con éxito (entre otros medios) adoptando dichos cambios (39, 73).
Así, el ejercicio físico regular puede ayudar a (51, 76, 77, 78, 79, 80, 81, 82):
- Aumentar la ovulación
- Mejorar la regularidad menstrual
- Mejorar equilibrio hormonal
- Mejorar la autoestima
- Aumentar la sensibilidad a la insulina
- Reducir la resistencia a la insulina
- Reducir la grasa corporal
- Mejorar la calidad de vida
Todas estas mejoras, a pesar de existir poca evidencia, se han visto aumentadas o relacionadas con la combinación de ejercicio físico, dieta y cambios de actitud. Sin embargo, el estudio realizado por Harrison et al (2012) (82) sugiere que el ejercicio físico de alta intensidad aislado es más efectivo para mejorar la sensibilidad a la insulina.
Todo esto significa y reafirma la importancia de adoptar hábitos saludables en mujeres con síndrome de ovarios poliquísticos (57, 79, 83, 84) para la mejora de la sintomatología, principalmente exceso de grasa y resistencia a la insulina (57, 83).
En cuanto a la tipología del ejercicio físico, tanto el ejercicio aeróbico como el de fuerza han mostrado mejoras en los síntomas/consecuencias del Síndrome del Ovario Poliquístico (60, 85, 86).
Respecto al entrenamiento aeróbic, ya sea mediante un método continuo uniforme o intermitente, en mujeres con Síndrome del Ovario Poliquístico parece mejorar la función sexual, los síntomas clínicos de hiperandrogenismo (reduce los niveles de testosterona), la ansiedad y la depresión (60). Por otro lado, cada método muestra diferencias en sus efectos (60):
Continuo uniforme:
- Puntación total FSFI (Female Sexual Function Index)
– Satisfacción sexual
– Dolor sexual
Intermitente:
- Reducción Índice cintura-cadera
- Mejorar la puntación total FSFI (Female Sexual Function Index)
– Mejorar el deseo sexual.
– Mejorar la excitación.
– Mejorar la lubricación
– Mejorar el orgasmo
– Mejorar la satisfacción
En los estudios realizados por Vigorito et al (2007) (87) y Giallauria et al (2008) (88), citados por Harrison et al, (2011) (85), vieron que un programa de ejercicio aeróbico de 30 minutos al 60-70% VO2máx, 3 veces por semana durante 3 meses, puede mejorar la sensibilidad a la insulina (85, 87), el fitness cardiopulmonar y general, y reducir el peso y al menos un factor inflamatorio (85, 87, 88).
Así, Harrison et al (2011) (85) concluyen que el entrenamiento aeróbico de intensidad moderada y corta duración aporta efectos favorables en mujeres con Síndrome del Ovario Poliquístico y sobrepeso en:
- Resultados a nivel reproductivo, incluidas ovulación y regulación menstrual.
- Reducción de peso corporal.
- Reducción de resistencia a la insulina
Pese a esto, afirman que falta evidencia respecto a otras intensidades [85].
También, se ha visto una relación entre el estado de la musculatura del suelo pélvico y la función sexual y entre la capacidad aeróbica y la fuerza de esta musculatura (60, 89, 90), lo que puede dar más razones para recomendar tanto el entrenamiento de la capacidad aeróbica como el entrenamiento de fuerza, además de resaltar la importancia del entrenamiento específico del suelo pélvico.
A pesar de esto, se debería de analizar si estas relaciones también se dan en mujeres con síndrome de ovarios poliquísticos.
Por otro lado, aplicando ejercicio físico de alta intensidad, se podría mejorar la resistencia a la insulina, los niveles de HDL, y aumentar las probabilidades de reducir el síndrome metabólico (57, 91).
El método HIIT (High Intensity Interval Training) en el síndrome de ovarios poliquísticos parece aportar mejoras en la resistencia a la insulina, en el sistema cardiovascular, niveles de HDL, y tanto HIIT como el entrenamiento de fuerza puede mejorar la composición corporal, así como el perfil hormonal (57, 92).
En lo que refiere al entrenamiento de fuerza en mujeres con Síndrome del Ovario Poliquístico, se han visto varios efectos positivos. Así, un programa progresivo de fuerza podría lograr las siguientes mejoras del síndrome (76, 86, 93):
- Mejorar la composición corporal
- Mejorar la puntación total FSFI (Female Sexual Function Index)
– Mejorar el deseo sexual
– Mejorar la excitación sexual.
– Mejorar la lubricación.
– Mejorar el dolor sexual. - Reducir la depresión
- Reducir la ansiedad.
Además, según Cheema et al (2014) [93], el entrenamiento de fuerza en el síndrome de ovarios poliquísticos está justificado por la similitud que existe en la resistencia a la insulina entre el SOP y la diabetes tipo 2, hipotetizando qué, las mejoras en este desorden metabólico en la diabetes tipo 2 (aumento significativo de sensibilidad a la insulina [94, 95] también pueden beneficiar a las mujeres con Síndrome del Ovario Poliquístico.
Por otro lado, Kogure et al (2018) (96) encontraron que mujeres con síndrome de ovarios poliquísticos presentan niveles de fuerza máxima ligeramente superiores en comparación con mujeres sin SOP, así como un desarrollo de la hipertrofia muscular ligeramente mayor y una mayor ganancia de fuerza máxima después de un programa progresivo de fuerza.
Este mayor aumento de fuerza, afirman, podría estar relacionado al hiperandrogenismo intrínseco del síndrome de ovarios poliquísticos, y que los efectos del programa fueron más evidentes a mitad de programa, debido a la mejora del hiperandrogenismo.
Los programas de fuerza estudiados (y especificados) están compuestos de las siguientes variables (76, 86):
- 10 ejercicios; 60-85%1RM; 3 series; 8-12 repeticiones/serie
- 5 ejercicios; 50-75%1RM; 3 series; 12 repeticiones/series
Pese a lo anterior, dadas las limitaciones de los estudios (como tamaño muestral, justificación de procedimientos, entrenamientos no supervisados…) (97) así como la variabilidad de las intervenciones (93) y la escasez de los mismos (97), no se pueden sacar conclusiones firmes sobre los efectos del entrenamiento de fuerza sobre los síntomas y consecuencias en el síndrome de ovarios poliquísticos (93, 97).
Así, la evidencia actual, aún sin poder aportar conclusiones en firme, orienta la prescripción de ejercicio físico en esta población hacia entrenamientos de moderada y alta intensidad, encontrando las principales mejoras en los factores cardio-metabólicos, reproductivos y psicológicos (57, 82, 85, 87, 98).
¿Cuáles son los síntomas del Síndrome de Ovario Poliquístico?
En la conferencia de expertos organizada por ESHRE/ASRM en Rotterdam (Criterios de Rotterdan, 2003)2, 3 definieron que para considerar la presencia de SOP, se deben cumplir dos de los tres criterios siguientes, luego de la exclusión de otras enfermedades relacionadas como la hiperplasia suprarrenal congénita, tumores secretos de andógenos, hiperprolactinemia, síndrome de Cushing y disfunción tiroidea:
- Disfunción del ciclo menstrual (oligo/anovulación).
- Hiperandrogenismo clínico o bioquímico (hirsutismo, acné y/o alopecia).
- Criterios ecográficos (morfología ovárica poliquística).
Partiendo de estos criterios, otros síntomas que se suelen dar en la mayor parte de las mujeres que padecen Síndrome de Ovario Poliquístico son:
- Irregularidad en el ciclo menstrual: en el 70% de las pacientes con SOP existe ausencia de menstruación, lo que conocemos como amenorrea. También es muy común que exista disminución del número de menstruaciones con ciclos largos mayores de 35 días (oligomenorrea), períodos de menstruación muy frecuentes con ciclos cortos inferiores a 25 días (polimenorrea) o menstruaciones de larga duración, abundantes y dolorosas (hipermenorrea).
- Síndrome Premenstrual (SPM): gran parte de la población femenina sufre de SPM, pero en pacientes con SOP este síndrome es más acusado, caracterizándose por presentar una semana antes de la menstruación síntomas físicos como aumento de peso, fatiga, migraña o náuseas; y síntomas psíquicos tales como depresión, cambios en la conducta, irritabilidad o alteración de la líbido.
- Hiperandrogenismo: en mujeres con SOP existe un incremento de la hormona masculina en sangre que puede dar lugar a un exceso de vello corporal y facial que es lo que conocemos como hirsutismo, acné y exceso de sebo. También es común que aparezcan hiperpigmentaciones (acantosis nigricans) en las zonas donde tenemos pliegues como la nuca, las axilas o la cara interna de los muslos y que haya pérdida de cabello siguiendo el patrón masculino. Se ha visto como la dieta para el SOP puede reducir este hiperandrogenismo en gran medida.
- Problemas de fertilidad: debido a la ausencia de ovulación en mujeres con SOP, puede producirse infertilidad.
- Insulinorresistencia: las mujeres con Síndrome de Ovario Poliquístico tienen mayor probabilidad de desarrollar diabetes mellitus, enfermedades cardíacas, síndrome metabólico, aborto, endometriosis, e incluso cáncer endometrial.
¿Cuáles son las causas del Síndrome de Ovario Poliquístico?
Si bien se desconoce la causa exacta del SOP, la evidencia científica destaca el componente genético o hereditario de este trastorno. El Síndrome de Ovario Poliquístico tiene una entidad multifactorial, cuyas causas principales son:
- Exceso de insulina: en mujeres que tienen Síndrome de Ovario Poliquístico hay una alteración en los receptores de insulina que da lugar a un aumento de glucosa en sangre y el páncreas tiene que compensar fabricando una mayor cantidad de insulina. Esto repercute directamente en el ovario provocando una alteración hormonal.
- Alteración hormonal: en pacientes con SOP existe una descompensación en la producción de hormonas segregando un exceso de andrógeno que da lugar a hirsutismo, acné o irregularidad en el ciclo menstrual de la mujer.
- Estilo de vida: llevar una mala alimentación, el sedentarismo, o el estrés puede provocarnos también esta alteración hormonal.
Por ello es fundamental una dieta para el SOP adecuada tanto para prevenirlo como para tratarlo, junto con la práctica de ejercicio y la medicación necesaria.
¿Cómo debe ser la dieta para el SOP?
A continuación analizamos la dieta para el SOP o dieta para el síndrome del ovario poliquístico, ¿Qué debes comer y qué debes evitar?
Abundante en frutas y verduras
Sabemos que son la base de la alimentación saludable y deben estar en las comidas principales ya que son una fuente de vitaminas, minerales, fibra y antioxidantes.
La dieta para el SOP debe contener frutas que tengan un menor índice glucémico como las cerezas, las ciruelas, el melocotón o el pomelo. Respecto a las verduras, aquellas de hoja verde como las espinacas o las acelgas, ayudaran a mantener los niveles de insulina más estables.

Rica en proteínas
En algunos estudios se ha podido comprobar que un consumo habitual de legumbres reduce los niveles de testosterona libre en sangre.
Debe contener carbohidratos integrales
La versión integral de las harinas tiene una mayor calidad nutricional por su contenido en fibra y un índice glucémico menor que va a reducir el riesgo de inflamación y obesidad.
Además, es importante que introduzcamos variedad de cereales como la espelta, la avena, el mijo, el amaranto o el trigo sarraceno ya que tendemos a consumir demasiado trigo en la dieta para el SOP.
Los marcadores metabólicos de resistencia a la insulina mejoran con la adherencia a dietas con hidratos de carbono de IG bajo.
Tiene que incluir grasas saludables
Se ha visto que las grasas omega 3 mejoran los niveles de colesterol y la sensibilidad a la insulina, controlando la producción hormonal.
Las podemos obtener a través de alimentos como el aguacate, las semillas, los frutos secos, el pescado azul, el aceite de oliva virgen extra y la yema de huevo.
Rica en vitaminas y minerales
Por un lado debemos obtener la vitamina D a través de alimentos como el pescado azul, los lácteos, la yema del huevo así como exponerse al sol diariamente; y por otro lado consumir alimentos ricos en vitamina B9 o ácido fólico como las frutas, las verduras de hoja verde y las legumbres, para mejorar la sintomatología y los ciclos menstruales, así como tratar problemas de fertilidad.
En la dieta para el SOP también es importante la ingesta de inositol, una sustancia del grupo B que regula los ciclos hormonales, aumenta la sensibilidad a la insulina y mejora la ovulación.
Elimina o disminuye el consumo de alimentos ultraprocesados
La bollería, los refrescos azucarados, el alcohol o los zumos de frutas contienen ingredientes poco saludables que pueden provocar picos de insulina por lo que la dieta para el SOP reducirá o eliminará este tipo de productos.
Consume la mayor parte de las calorías durante el día
Se ha visto que administrar las calorías en mayor número por la mañana mejora tanto los marcadores hormonales como los metabólicos en la dieta para el SOP4.
Esto es así debido a la importancia de los ritmos circadianos en la regulación de la glucosa, que provoca que la respuesta de la glucosa postprandial sea más elevada por la noche que por la mañana y del efecto positivo sobre la prevención del síndrome metabólico que tiene el hecho de ingerir los hidratos de carbono en mayor proporción por la mañana5,6.
Conclusiones sobre la dieta para el SOP
También será necesaria la medicación adecuada para tratar el Síndrome de Ovario Poliquístico a través de medicamentos antiandrógenos, metmorfina o píldoras anticonceptivas pautadas por el médico. Para las mujeres con intención de embarazo se debe iniciar la inducción de la ovulación con los medicamentos como el clomifero y letrozol5.
El Síndrome del Ovario Poliquístico no tiene cura hoy por hoy, pero podemos mejorar la calidad de vida de la paciente a través de un tratamiento específico enfocado a minimizar los síntomas mediante una dieta para el SOP adecuada, la práctica de actividad física, el tratamiento médico y una mejor gestión del estrés.
Certificación online sobre el SOP
Si te has quedado con ganas de más y deseas ampliar tu formación en el SOP, te recomendamos nuestra certificación online.
En esta certificación vamos a conocer en qué consiste el SOP, la prevalencia en la población y en base a qué criterios se diagnostica. Aprenderás paso a paso, cómo tratar el síndrome del ovario poliquístico y mejorarlo con la alimentación y qué aspectos tener en cuenta a la hora de entrenar.
Descubre cuáles son los factores de riesgo más importantes a tener en cuenta para prevenir la aparición del SOP.
En esta certificación vamos a aprender qué es el Síndrome de Ovario Poliquístico (SOP), cómo se manifiesta en la mujer y la importancia de un estilo de vida saludable en el manejo de los síntomas.
Aprende paso a paso, cómo tratar el síndrome del ovario poliquístico y mejorarlo con la alimentación y qué aspectos tener en cuenta a la hora de entrenar.
Referencias bibliográficas
- Kujanpää, L., Arffman, R. K., Pesonen, P., Korhonen, E., Karjula, S., Järvelin, M. R., Franks, S., Tapanainen, J. S., Morin-Papunen, L., & Piltonen, T. T. (2022). Women with polycystic ovary syndrome are burdened with multimorbidity and medication use independent of body mass index at late fertile age: A population-based cohort study. Acta obstetricia et gynecologica Scandinavica, 101(7), 728–736.
- ESHRE/ASRM Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome. Fertil Steril 2004; 81:19-25. dieta para el SOP
- The Rotterdam ESHRE/ASRM-sponsored PCOS Consensus Workshop Group Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome (PCOS). Hum Reprod;19:41-47.
- Pescador, M. T. M. (2019). Análisis de los efectos de distintas intervenciones dietéticas en el síndrome del ovario poliquístico: trabajo de revisión bibliográfica.
- Leung GKW, Huggins CE, Bonham MP. (2019). Effect of meal timing on postprandial glucose responses to a low glycemic index meal: A crossover trial in healthy volunteers. Clin Nutr. 38(1):p. 465-71.
- Almoosawi S, Prynne CJ, Hardy R, Stephen AM. (2013). Time-of-day and nutrient composition of eating occasions: prospective association with the metabolic syndrome in the 1946 British birth cohort. Int J Obes, 37(5):p. 725-31.
- Girón, G. A. S. (2022). Diagnóstico y tratamiento del síndrome de ovario poliquístico e infertilidad. Revista Diversidad Científica, 2(2), 85-93.
Conclusiones
El síndrome del ovario poliquístico es una patología neuro-endrocina muy frecuente en mujeres en edad reproductiva, y aunque existen varias propuestas los criterios de diagnóstico del Síndrome del Ovario Poliquístico que actualmente se emplean son los propuestos por la NIH y ESHRE/ASRM en 1990 y 2003 respectivamente.
El no haber un consenso único para su diagnóstico hace que se den varios problemas:
- Muchas mujeres no tengan claro si padecen el síndrome o no.
- Hay estudios que utilizan los criterios NIH y otros que utilizan los criterios Rotterdam, lo que impide aporta conclusiones en firme sobre su tratamiento.
- Muchas mujeres podrían no estar seguras de haber recibido un diagnóstico seguro, lo que cual puede llevar a que el tratamiento recibido no sea adecuado.
El síndrome del ovario poliquístico es una patología cuya sintomatología varía mucho a nivel individual, presentando algunos signos que son muy frecuentes, como son la irregularidad menstrual, dificultad o imposibilidad para concebir, el hiperandrogenismo y la resistencia a la insulina.
Estos signos pueden estar muy relacionados entre sí, habiéndose sugerido que la resistencia a la insulina, provocando una consecuente hiperinsulinemia, hace que se produzca un exceso de andrógenos ováricos, lo cual podría altera los ciclos menstruales dificultando/impidiendo la concepción.
Por tanto, y teniendo en cuenta el aumento del riesgo de padecer otras patologías (diabetes, HTA…), el Síndrome del Ovario Poliquístico afecta directamente a la calidad de vida de las mujeres que lo padecen, de su descendencia e incluso de sus hermanos si lo tuviesen.
Existe un consenso en que el primer tratamiento debe ser la adopción de hábitos saludables (nutrición, ejercicio físico y actitud).
Sin embargo, respecto al ejercicio físico, la evidencia actual tan solo permite reconocer el potencial beneficio que aporta tanto el entrenamiento aeróbico como el entrenamiento de fuerza, apuntando a que los mayores beneficios los aporta el entrenamiento de moderada-alta intensidad.
Sin embargo, la heterogeneidad de los estudios impide conocer tipo y características que aporten los mejores beneficios.
Podcast «Síndrome del Ovario Poliquístico»: Play in new window |
Suscríbete a Apple Podcasts | Spotify | Google Podcasts |
Referencias bibliográficas
- Sir P., Preisler R., Magendzo N. (2013). Síndrome de ovario poliquístico. diagnóstico y manejo. Revista Médica Clínica Las Condes. 24. 818-826.
- Carvajal G.R., Herrera G.C., Porcile J.A. (2010). Espectro fenotípico del síndrome de ovario poliquístico. Revista Chilena De Obstetricia Y Ginecología, 75(2), 124-132.
- Laven J.S., Imani B., Eijkemans M.J., Fauser B.C. (2002). New approach to polycystic ovary syndrome and other forms of anovulatory infertility. Obstetrical & gynecological survey, 57(11), 755–767.
- Builes C.A., Diaz I., Castañeda J., Pérez, L.E. (2006). Caracterización clínica y bioquímica de la mujer con síndrome de ovario poliquístico. Revista Colombiana De Obstetricia Y Ginecología, 57(1), 36-44.
- Knochenhauer E.S., Key T.J., Kahsar Miller M., Waggoner W., Boots L.R., Azziz R. (1998). Prevalence of the Polycystic Ovary Syndrome in Unselected Black and White Women of the Southeastern United States: A Prospective Study. The Journal of Clinical Endocrinology and Metabolism, 83(9), 3078-3082.
- Asunción M., Calvo R.M., San Millán J.L., Sancho J., Avila S., Escobar Morreale H.F. (2000). A Prospective Study of the Prevalence of the Polycystic Ovary Syndrome in Unselected Caucasian Women from Spain1. The Journal of Clinical Endocrinology & Metabolism, 85(7), 2434-2438.
- Azziz R., Woods, K.S., Reyna R., Key T.J., Knochenhauer, E.S., Yildiz B.O. (2004). The Prevalence and Features of the Polycystic Ovary Syndrome in an Unselected Population. The Journal of Clinical Endocrinology & Metabolism, 89(6), 2745-2749.
- Saleh A.M., Khalil H.S. (2004). Review of nonsurgical and surgical treatment and the role of insulin-sensitizing agents in the management of infertile women with polycystic ovary syndrome. Acta obstetricia et gynecologica Scandinavica, 83(7), 614–621.
- Franks S. (1995). Polycystic ovary syndrome. New England Journal of Medicine, 333(13), 853–861.
- Franks, S. (1989). Polycystic ovary syndrome: a changing perspective. Clinical Endocrinology, 31(1), 87–120.
- Conway G.S., Honour J.W., Jacobs H.S. (1989). Heterogeneity of the polycystic ovary syndrome: clinical, endocrine and ultrasound features in 556 patients. Clinical Endocrinology, 30(4), 459-470.
- Azziz R., Sanchez L.A., Knochenhauer E.S., Moran C., Lazenby J., Stephens K. C., Taylor K., Boots L.R. (2004). Androgen Excess in Women: Experience with Over 1000 Consecutive Patients. The Journal of Clinical Endocrinology & Metabolism, 89(2), 453–462. 2
- Stein I.F., Leventhal M.L. (1935). Amenorrhea associated with bilateral polycystic ovaries. American Journal of Obstetrics and Gynecology, 29(2), 181–191.
- Mayo Foundation for Medical Education and Research (14/12/2019). Mayo Clinic: Atención al paciente e información médica. Enfermedades y Afecciones. Hirsutismo. Scottsdale, EE.UU.: Mayo Clinic. Recuperado de: https://www.mayoclinic.org/es-es/diseases-conditions/hirsutism/symptoms-causes/syc-20354935 Consultado el 28/05/2020
- Escobar Morreale H.F., Luque Ramírez M., San Millán J.L. (2005). The Molecular-Genetic Basis of Functional Hyperandrogenism and the Polycystic Ovary Syndrome. Endocrine Reviews, 26(2), 251-282.
- Real Academia Española (2020) Real Academia Española: Diccionario de la Lengua Española. Síndrome. Madrid, España: Diccionario de la Lengua Española. Consultado el 30/05/2020.
- 17. Sir Petermann T., Maliqueo M., Codner E., Echiburú B., Crisosto N., Pérez V., PérezBravo F., Cassorla F. (2007). Early Metabolic Derangements in Daughters of Women with Polycystic Ovary Syndrome. The Journal of Clinical Endocrinology & Metabolism, 92(12), 4637-4642.
- Rebar R., Judd H.L., Yen S.S., Rakoff J., Vandenberg G., Naftolin F. (1976). Characterization of the inappropriate gonadotropin secretion in polycystic ovary syndrome. The Journal of Clinical Investigation, 57(5), 1320-1329.
- Holte J. (1996). Disturbances in insulin secretion and sensitivity in women with the polycystic ovary syndrome. Bailliere’s Clinical Endocrinology and Metabolism, 10(2), 221-247.
- Biblioteca Nacional de Medicina de EE.UU. (26/02/2020) Medine Plus: Pruebas médicas. Prueba de niveles de la hormona luteinizante (HL). Rockville Pike, EE.UU.: Medine Plus. Recuperado de: https://medlineplus.gov/spanish/pruebas-de-laboratorio/prueba-de-niveles-de-la-hormona-luteinizante-hl/ Consultado el 26/05/2020.
- Biblioteca Nacional de Medicina de EE.UU. (25/02/2022) Medine Plus: Pruebas médicas. Prueba de niveles de la hormona foliculoestimulante (FSH). Rockville Pike, EE.UU.: Medine Plus. Recuperado de: https://medlineplus.gov/spanish/pruebas-de-laboratorio/prueba-de-niveles-de-la-hormona-foliculoestimulante-fsh/ Consultado 26/05/2020
- Austin C.P. (Consultado el 30/05/2020) National Human Genome Research Institute: About Genomics. Talking Glossary of Genetic term. Fenotipo. Rockville Pike, EE.UU: https://www.genome.gov/es/genetics-glossary/Fenotipo
- The Rotterdam ESHRE/ASRM-Sponsored PCOS Consensus Workshop Group (2004) Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome. Fertility and Sterility, 81(1), 19-25.
- Clínica Universidad de Navarra (2020) Clínica Universidad de Navarra: Diccionario Médico. Hiperandrogenismo. Pamplona, España: Diccionario Médico. Recuperado de: https://www.cun.es/diccionario-medico/terminos/hiperandrogenismo Consultado el 29/05/2020
- Clínica Universidad de Navarra (2020) Clínica Universidad de Navarra: Diccionario Médico. Anovulación. Pamplona, España: Diccionario Médico. Recuperado de: https://www.cun.es/diccionario-medico/terminos/anovulacion Consultado el 29/05/2020
- Real Academia Española (2020) Real Academia Española: Diccionario de la Lengua Española. Oligo-. Madrid, España: Diccionario de la Lengua Española. Consultado el 29/05/2020
- Jonard S. Robert Y., Cortet Rudelli C., Pigny P., Decanter C., Dewailly D. (2003). Ultrasound examination of polycystic ovaries: is it worth counting the follicles? Human Reproduction, 18(3), 598–603.
- Adams J., Franks S., Polson D.W., Mason H.D., Abdulwahid N., Tucker M., Morris D.V., Price J., Jacobs H.S. (1985). Multifollicular ovaries: clinical and endocrine features and response to pulsatile gonadotropin releasing hormone. Lancet (London, England), 2(8469-70), 1375–1379.
- Biblioteca Nacional de Medicina de EE.UU. (07/05/2020) Medine Plus: Enciclopedia Médica. Quistes Ováricos. Rockville Pike, EE.UU: Medine Plus. Recuperado de: https://medlineplus.gov/spanish/ency/article/001504.htm Consultado el 29/05/2020
- Velázquez Domínguez J.A., Mendieta Márquez E. (2004) Desarrollo Folicular. Encuentros de Biología, 98, 4-6. ISSN: 1134-8496. Recuperado de http://www.encuentros.uma.es/assets/journals/1/98.pdf
- Azziz R. (2006). Diagnosis of Polycystic Ovarian Syndrome: The Rotterdam Criteria Are Premature. The Journal of Clinical Endocrinology & Metabolism, 91(3), 781-785.
- Azziz R., Carmina E., Dewailly D., Diamanti Kandarakis E., Escobar Morreale H.F., Futterweit W., Janssen O.E., Legro R.S., Norman R. J., Taylor A.E., Witchel S.F., Androgen Excess Society (2006). Positions statement: criteria for defining polycystic ovary syndrome as a predominantly hyperandrogenic syndrome: an Androgen Excess Society guideline. The Journal of clinical endocrinology and metabolism, 91(11), 4237–4245.
- Dutkowska A., Konieczna A., BreskaKruszewska J., Sendrakowska M., Kowalska I., Rachoń D. (2019). Recomendations on non-pharmacological interventions in women with PCOS to reduce body weight and improve metabolic disorders. Endokrynologia Polska, 70(2), 198–212. https://doi.org/10.5603/ep.a2019.0006
- Mayo Foundation for Medical Education and Research (24/01/2019). Mayo Clinic: Atención al paciente e información médica. Hiperinsulinemia: ¿es diabetes? Scottsdale, EE.UU.: Mayo Clinic. Recuperado de: https://www.mayoclinic.org/es-es/diseases-conditions/type-2-diabetes/expert-answers/hyperinsulinemia/faq-20058488 Consultado el 30/05/2020
- Nestler J.E., Jakubowicz D.J., de Vargas A.F., Brik C., Quintero N., Medina F. (1998). Insulin Stimulates Testosterone Biosynthesis by Human Thecal Cells from Women with Polycystic Ovary Syndrome by Activating Its Own Receptor and Using Inositolglycan Mediators as the Signal Transduction System. The Journal of Clinical Endocrinology and Metabolism, 83(6), 2001-2005.
- Teede H., Deeks A., Moran L. (2010). Polycystic ovary syndrome: a complex condition with psychological, reproductive and metabolic manifestations that impacts on health across the lifespan. BMC Medicine, 8(1), 41.
- March W. A., Moore V. M., Willson K.J., Phillips D.I. W., Norman R. J., Davies, M.J. (2010). The prevalence of polycystic ovary syndrome in a community sample assessed under contrasting diagnostic criteria. Human Reproduction, 25(2), 544-551.
- Bozdag G., Mumusoglu S., Zengin D., Karabulut E., Yildiz B.O. (2016). The prevalence and phenotypic features of polycystic ovary syndrome: a systematic review and meta-analysis. Human Reproduction, 31(12), 2841-2855.
- Norman R.J., Wu R., Stankiewicz M.T. (2004). 4: Polycystic ovary syndrome. Medical Journal of Australia, 180(3), 132–137.
- Carmina E., Rosato F., Jannì A., Rizzo M., Longo R.A. (2006). Relative Prevalence of Different Androgen Excess Disorders in 950 Women Referred because of Clinical Hyperandrogenism. The Journal of Clinical Endocrinology & Metabolism, 91(1), 2-6.
- Cerda C., Pérez Ayuso R., Riquelme A., Soza A., Villaseca P., Sir Petermann T., Espinoza M., Pizarro M., Solis N., Miquel J F., Arrese M. (2007). Nonalcoholic fatty liver disease in women with polycystic ovary syndrome. Journal of Hepatology, 47, 412–417.
- Moran L. J., Misso M. L., Wild R.A., Norman R.J. (2010). Impaired glucose tolerance, type 2 diabetes and metabolic syndrome in polycystic ovary syndrome: a systematic review and meta-analysis. Human Reproduction Update, 16(4), 347-363.
- Mani H., Levy M. J., Davies M.J., Morris D.H., Gray L.J., Bankart J., Blackledge H., Khunti K., Howlett T. A. (2013). Diabetes and cardiovascular events in women with polycystic ovary syndrome: a 20‐year retrospective cohort study. Clinical Endocrinology, 78(6), 926-934.
- Asociación Española de Pediatría (14/03/2018). Asociación Española de Pediatría: Adrenarquia Prematura. Madrid, España: Asociación Española de Pediatría. Recuperado de https://www.aeped.es/rss/en-familia/adrenarquia-prematura Consultado 27/05/2020
- Mayo Foundation for Medical Education and Research (13/09/2019). Mayo Clinic: Atención al paciente e información médica. Enfermedades y Afecciones. Pubertad Precoz. Scottsdale, EE.UU.: Mayo Clinic. Recuperado de: https://www.mayoclinic.org/es-es/diseases-conditions/precocious-puberty/symptoms-causes/syc-20351811 Consultado 27/05/2020
- Clínica Universidad de Navarra (2020) Clínica Universidad de Navarra: Diccionario Médico. eumenorrea. Pamplona, España: Diccionario Médico. Recuperado de: https://www.cun.es/diccionario-medico/terminos/eumenorrea Consultado el 27/05/2020
- Pasquali R., Gambineri A. (2006). Polycystic Ovary Syndrome: A Multifaceted Disease from Adolescence to Adult Age. Annals of the New York Academy of Sciences, 1092(1), 158-174.
- Dunaif A. (1997). Insulin resistance and the polycystic ovary syndrome: mechanism and implications for pathogenesis. Endocrine Reviews, 18(6), 774-800.
- Dunaif A., Graf M., Mandeli J., Laumas V., Dobrjansky A. (1987). Characterization of Groups of Hyperaiidrogenic Women with Acanthosis Nigricans, Impaired Glucose Tolerance, and/or Hyperinsulinemia. The Journal of Clinical Endocrinology & Metabolism, 65(3), 499-507.
- Biblioteca Nacional de Medicina de EE.UU. (07/05/2020) Medine Plus: Enciclopedia Médica. Virilización. Rockville Pike, EE.UU: Medine Plus. Recuperado de https://medlineplus.gov/spanish/ency/article/002339.htm Consultado 27/05/200
- Benham J.L., Yamamoto J.M., Friedenreich C.M., Rabi D.M., Sigal R.J. (2018). Role of exercise training in polycystic ovary syndrome: a systematic review and meta-analysis. Clinical Obesity, 8(4), 275-284.
- Wijeyaratne C.N., Balen A.H., Barth J.H., Belchetz P.E. (2002). Clinical manifestations and insulin resistance (IR) in polycystic ovary syndrome (PCOS) among South Asians and Caucasians: is there a difference? Clinical Endocrinology, 57(3), 343–350.
- Ehrmann D.A. (2005). Polycystic Ovary Syndrome. New England Journal of Medicine, 352(12), 1223–1236.
- Gopal M., Duntley S., Uhles M., Attarian H. (2002). The role of obesity in the increased prevalence of obstructive sleep apnea syndrome in patients with polycystic ovarian syndrome. Sleep Medicine, 3(5), 401–404.
- Vgontzas A.N., Legro R.S., Bixler E.O., Grayev A., Kales A., Chrousos G.P. (2001). Polycystic Ovary Syndrome Is Associated with Obstructive Sleep Apnea and Daytime Sleepiness: Role of Insulin Resistance1. The Journal of Clinical Endocrinology & Metabolism, 86(2), 517–520.
- Barnard L., Ferriday D., Guenther N., Strauss B., Balen A.H., Dye L. (2007). Quality of life and psychological well being in polycystic ovary syndrome. Human Reproduction, 22(8), 2279-2286.
- Hiam D., Patten R., GibsonHelm M., Moreno Asso A., McIlvenna L., Levinger I., Harrison C., Moran L.J., Joham A., Parker A., Shorakae S., Simar D., Stepto N. (2019). The effectiveness of high intensity intermittent training on metabolic, reproductive and mental health in women with polycystic ovary syndrome: study protocol for the iHIT- randomised controlled trial. Trials, 20(1), 221.
- Azziz R., Marin C., Hoq L., Badamgarav, E., Song, P. (2005). Health Care-Related Economic Burden of the Polycystic Ovary Syndrome during the Reproductive Life Span. The Journal of Clinical Endocrinology & Metabolism, 90(8), 4650-4658.
- Lim S.S., Davies M.J., Norman R.J., Moran L.J. (2012). Overweight, obesity and central obesity in women with polycystic ovary syndrome: a systematic review and meta-analysis. Human reproduction update, 18(6), 618–637.
- Lopes, I. P., Ribeiro, V. B., Reis, R. M., Silva, R. C., Dutra de Souza, Hugo Celso, Kogure, G. S., Ferriani, R. A., & Silva Lara, Lúcia Alves da. (2018). Comparison of the Effect of Intermittent and Continuous Aerobic Physical Training on Sexual Function of Women With Polycystic Ovary Syndrome: Randomized Controlled Trial. The Journal of Sexual Medicine, 15(11), 1609-1619.
- Bazarganipour F., Ziaei S., Montazeri A., Foroozanfard F., Kazemnejad A., Faghihzadeh S. (2014). Sexual Functioning among Married Iranian Women with Polycystic Ovary Syndrome. International Journal of Fertility & Sterility, 8(3), 273-280.
- Dashti S., Latiff L.A., Hamid H.A., Sani S. M., Akhtari Zavare M., Abu Bakar A.S., Binti Sabri N.A., Ismail M., Esfehani A.J. (2016). Sexual Dysfunction in Patients with Polycystic Ovary Syndrome in Malaysia. Asian Pacific Journal of Cancer Prevention: APJCP, 17(8), 3747.
- Eftekhar T., Sohrabvand F., Zabandan N., Shariat M., Haghollahi F., Ghahghaei Nezamabadi A. (2014). Sexual dysfunction in patients with polycystic ovary syndrome and its affected domains. Iranian Journal of Reproductive Medicine, 12(8), 539-546.
- Real Academia Española (2020) Real Academia Española: Diccionario de la Lengua Española. menarquia. Madrid, España: Diccionario de la Lengua Española. Recuperado online. Consultado el 27/05/2020
- Goodarzi M.O., Azziz R. (2006). Diagnosis, epidemiology, and genetics of the polycystic ovary syndrome. Best Practice & Research Clinical Endocrinology & Metabolism, 20(2), 193-205.
- Yildiz B.O., Yarali H., Oguz H., Bayraktar M. (2003). Glucose Intolerance, Insulin Resistance, and Hyperandrogenemia in First Degree Relatives of Women with Polycystic Ovary Syndrome. The Journal of Clinical Endocrinology & Metabolism, 88(5), 2031-2036.
- Legro R.S., Kunselman A.R., Demers L., Wang S.C., Bentley Lewis R., Dunaif A. (2002). Elevated Dehydroepiandrosterone Sulfate Levels as the Reproductive Phenotype in the Brothers of Women with Polycystic Ovary Syndrome. The Journal of Clinical Endocrinology & Metabolism, 87(5), 2134-2138.
- Mayo Foundation for Medical Education and Research (16/11/2019). Mayo Clinic: Atención al paciente e información médica. Enfermedades y Afecciones. Preeclampsia. Scottsdale, EE.UU.: Mayo Clinic. Recuperado de: https://www.mayoclinic.org/es-es/diseases-conditions/preeclampsia/symptoms-causes/syc-20355745 Consultado 27/05/2020
- Colilla S., Cox, N.J., Ehrmann D.A. (2001). Heritability of Insulin Secretion and Insulin Action in Women with Polycystic Ovary Syndrome and Their First Degree Relatives1. The Journal of Clinical Endocrinology & Metabolism, 86(5), 2027-2031.
- Legro R.S., Kunselman A.R., Dodson W.C., Dunaif A. (1999). Prevalence and Predictors of Risk for Type 2 Diabetes Mellitus and Impaired Glucose Tolerance in Polycystic Ovary Syndrome: A Prospective, Controlled Study in 254 Affected Women. The Journal of Clinical Endocrinology and Metabolism, 84(1), 165-169.
- Homburg R. (2006). Pregnancy complications in PCOS. Best Practice & Research Clinical Endocrinology & Metabolism, 20(2), 281–292.
- Jakubowicz D.J., Iuorno M.J., Jakubowicz S., Roberts K.A., Nestler J.E. (2002). Effects of Metformin on Early Pregnancy Loss in the Polycystic Ovary Syndrome. The Journal of Clinical Endocrinology & Metabolism, 87(2), 524-529.
- Amsterdam ESHRE/ASRM-Sponsored 3rd PCOS Consensus Workshop Group (2012). Consensus on women’s health aspects of polycystic ovary syndrome (PCOS). Human reproduction (Oxford, England), 27(1), 14–24.
- Sirmans S.M., Pate KA. (2013). Epidemiology, diagnosis, and management of polycystic ovary syndrome. Clinical Epidemiology, 6, 1-13.
- Badawy A., Elnashar A. (2011). Treatment options for polycystic ovary syndrome. International Journal of Women’s Health, 3, 25-35.
- Thomson R.L., Buckley J.D., Noakes M., Clifton P.M., Norman R.J., Brinkworth G.D. (2008). The Effect of a Hypocaloric Diet with and without Exercise Training on Body Composition, Cardiometabolic Risk Profile, and Reproductive Function in Overweight and Obese Women with Polycystic Ovary Syndrome. The Journal of Clinical Endocrinology & Metabolism, 93(9), 3373–3380.
- Aubuchon M., Laughbaum N., Poetker A., Williams D., Thomas M. (2009). Supervised short-term nutrition and exercise promotes weight loss in overweight and obese patients with polycystic ovary syndrome. Fertility and Sterility, 91(4), 1336–1338.
- Turan V., Mutlu E.K., Solmaz U. Ekin a., Tosun O., Tosun G., Mat E., Gezer C., Maloc M. (2015) . Benefits of short-term structured exercise in non-overweight women with polycystic ovary syndrome: a prospective randomized controlled study. J Phys Ther Sci, 27: 2293–2297.
- Vizza L., Smith C.A., Swaraj S., Agho K., Cheema B.S. (2016). The feasibility of progressive resistance training in women with polycystic ovary syndrome: a pilot randomized controlled trial. BMC Sports Science, Medicine and Rehabilitation, 8(14).
- Nybacka A., Carlstrom K., Stahle A., Nyren S., Hellstrom P., Hirschberg A. (2011). Randomized comparison of the influence of dietary management and/or physical exercise on ovarian function and metabolic parameters in overweight women with polycystic ovary syndrome. Fertility and Sterility, 96(6), 1508.
- Jedel E., Labrie F., Odén A., Holm G., Nilsson L., Janson P. O., Lind A.K., Ohlsson C., Stener Victorin E. (2011). Impact of electro-acupuncture and physical exercise on hyperandrogenism and oligo/amenorrhea in women with polycystic ovary syndrome: a randomized controlled trial. American Journal of Physiology-Endocrinology and Metabolism, 300(1), E37–E45.
- Harrison C.L., Stepto N.K., Hutchison S.K., Teede H.J. (2012). The impact of intensified exercise training on insulin resistance and fitness in overweight and obese women with and without polycystic ovary syndrome. Clinical Endocrinology, 76(3), 351-357.
- Teede H.J., Misso M.L., Costello M.F., Dokras A., Laven J., Moran L., Piltonen T., Norman R. (2018). Recommendations from the international evidence-based guideline for the assessment and management of polycystic ovary syndrome. Clinical Endocrinology, 89(3), 251-268.
- Cassar S., Misso M.L., Hopkins W.G., Shaw C.S., Teede H.J., Stepto N.K. (2016). Insulin resistance in polycystic ovary syndrome: a systematic review and meta-analysis of euglycaemic–hyperinsulinaemic clamp studies. Human Reproduction, 31(11), 2619-2631.
- Harrison C.L., Lombard C.B., Moran L.J., Teede H.J. (2011). Exercise therapy in polycystic ovary syndrome: a systematic review. Human Reproduction Update, 17(2), 171-183.
- Lara L.A.S., Ramos F.K.P., Kogure G.S., Costa R.S., Silva de Sá M. F., Ferriani R.A., dos Reis R.M. (2015). Impact of Physical Resistance Training on the Sexual Function of Women with Polycystic Ovary Syndrome. The Journal of Sexual Medicine, 12(7), 1584-1590.
- Vigorito C., Giallauria F., Palomba S., Cascella T., Manguso F., Lucci R., De Lorenzo A., Tafuri D., Lombardi G., Colao A., Orio F. (2007). Beneficial effects of a three-month structured exercise training program on cardiopulmonary functional capacity in young women with polycystic ovary syndrome. The Journal of clinical endocrinology and metabolism, 92(4), 1379–1384.
- Giallauria F., Palomba S., Maresca L., Vuolo L., Tafuri D., Lombardi G., Colao A., Vigorito C., Francesco O. (2008). Exercise training improves autonomic function and inflammatory pattern in women with polycystic ovary syndrome (PCOS). Clinical endocrinology, 69(5), 792–798.
- Rivalta M., Sighinolfi M.C., Micali S., De Stefani S., Bianchi G. (2010). Sexual function and quality of life in women with urinary incontinence treated by a complete pelvic floor rehabilitation program (biofeedback, functional electrical stimulation, pelvic floor muscles exercises, and vaginal cones). The Journal of Sexual Medicine, 7(3), 1200-1208.
- Jürgensen S.P., Borghi Silva A., Bastos A.M.F.G., Correia G.N., Pereira Baldon V.S., Cabiddu R., Catai A.M., Driusso P. (2017) Relationship between aerobic capacity and pelvic floor muscles function: a cross-sectional study. Brazilian Journal of Medical and Biological Research, 50(11), e5096.
- Greenwood E.A., Noel M.W., Kao C.N., Shinkai K., Pasch L.A., Cedars M.I., Huddleston, H.G. (2016). Vigorous exercise is associated with superior metabolic profiles in polycystic ovary syndrome independent of total exercise expenditure. Fertility and Sterility, 105(2), 486-493.
- Almenning I., RieberMohn A., Lundgren K.M., Shetelig Løvvik T., Garnæs K.K., Moholdt T. (2015). effects of high intensity interval training and strength training on metabolic, cardiovascular and hormonal outcomes in women with polycystic ovary syndrome: a pilot study. PloS One, 10(9), e0138793.
- Cheema B., Vizza L., Swaraj S. (2014). Progressive resistance training in polycystic ovary syndrome: can pumping iron improve clinical outcomes? Sports Medicine, 44(9), 1197-1207.
- Ibáñez J., Izquierdo M., Argüelles I., Forga L., Larrión J.L., García Unciti M., Idoate F., Gorostiaga E.M. (2005). Twice-weekly progressive resistance training decreases abdominal fat and improves insulin sensitivity in older men with type 2 diabetes. Diabetes care, 28(3), 662–667.
- Shaibi G.Q., Cruz M.L., Ball G.D.C., Weigensberg M.J., Salem G.J., Crespo N.C., Goran M.I. (2006). Effects of resistance training on insulin sensitivity in overweight latino adolescent males. Medicine and Science in Sports and Exercise, 38(7), 1208-1215.
- Kogure G., Silva R., Miranda Furtado C., Ribeiro V., Pedroso D., Melo A., Ferriani R., Reis R.M. (2018). Hyperandrogenism enhances muscle strength after progressive resistance training, independent of body composition, in women with polycystic ovary syndrome. Journal of Strength and Conditioning Research, 32(9), 2642-2651.
- Pericleous P., Stephanides S. (2018). Can resistance training improve the symptoms of polycystic ovary syndrome? BMJ Open Sport & Exercise Medicine, 4(1), e000372.
- Hutchison S.K., Stepto N.K., Harrison C. L., Moran L.J., Strauss B. J., Teede, H.J. (2011). Effects of exercise on insulin resistance and body composition in overweight and obese women with and without polycystic ovary syndrome. The Journal of Clinical Endocrinology & Metabolism, 96(1), E48-E56.
Coautor | Pablo Sánchez González. Puedes leer todos sus artículos aquí.