En este artículo descubriremos en qué consiste el glutation, así como principales utilidades en la alimentación y asociaciones con enfermedades.
También, mencionaremos algunos alimentos que contienen una gran cantidad de este tripéptido.
¿Qué es el glutation?
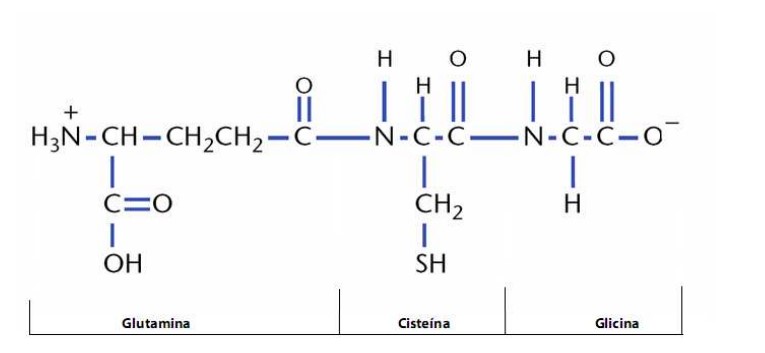
El glutation, también conocido por las siglas GSH, es un tripéptido no proteínico derivado de los aminoácidos, formado por L-cisteína, ácido L-glutámico y glicina.
Además, contiene un enlace peptídico característico entre el grupo amino de la cisteína y el grupo carboxilo de la cadena lateral del glutamato. (1)
Por otra parte, es considerado un antioxidante ya que ayuda a proteger las especies reactivas de oxígeno, como los radicales libres y los peróxidos, siendo además un nucleofílico en azufre que ataca los aceptores conjugados electrofílicos. (1)
¿Cuál es su poder antioxidante?
A continuación, vamos a observar una tabla que refleja algunas parejas biológicas en su forma oxidada y reducida, entre las que se encuentra el glutatión: (1)
|
Pareja biológicas de óxido-reducción |
Potential Redox (mV a pH 3,5) |
|---|---|
| O2 / H2O | + 1022 mV |
| Q / QH2 | + 475 mV |
| G-SS-G / G-SH | – 240 mV |
Cabe destacar que este compuesto no proteico se considera tiólico (contiene el grupo funcional con un átomo de azufre y otro de hidrógeno) y se encuentra en la mayoría de organismos procariotas y mamíferos.
Consecuentemente, el glutatión reduce cualquier enlace disulfuro que esté formado dentro de proteínas citoplasmáticas de cisteínas, debido a que participa en la donación de electrones.
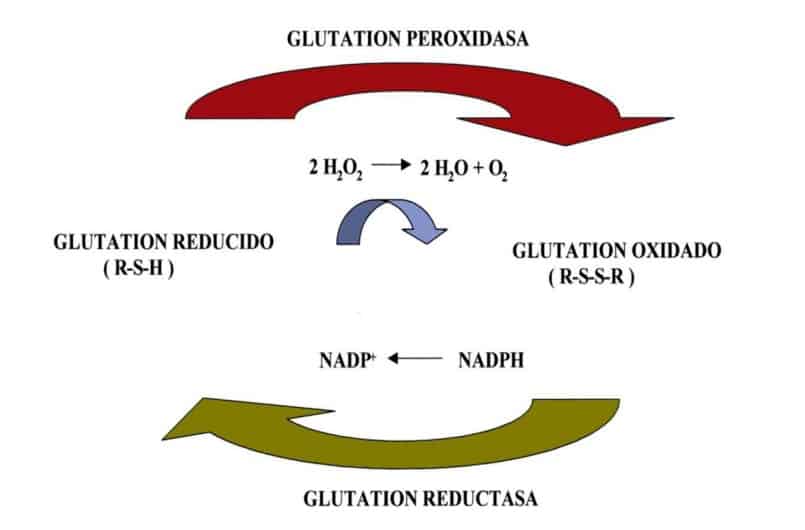
Durante el proceso de óxido-reducción, tal y como vemos en la tabla, el GSH se convierte en su forma oxidada disulfuro de esta substancia (GSSG). (1)
Enzimas glutatión
Es una enzima que se encarga de catalizar la reacción de oxidación de GSH a glutatión disulfuro, en la que es necesaria la utilización del peróxido de hidrógeno y el cofactor selenio. (1)
2 Glutatión + H2O2 Glutatión disulfuro + 2 H2O
La principal de esta enzima es proteger al organismo del efecto degradante de los hidroperóxidos que se forman de manera endógena.
Glutatión S-transferasa
Es una isoenzima metabólica, multifuncional y dimérica, que cataliza la conjugación de la forma reducida de esta substancia (GSH) a xenobióticos sustratos con el objetivo de facilitar una desintoxicación. Para catalizar este proceso de conjugación es necesaria la presencia de un grupo sulfidrilo, y los compuestos resultantes serán más solubles en agua. (1)
Glutatión sintetasa
Es una enzima que se encarga de la síntesis del glutatión.
Como ya hemos mencionado anteriormente, este no se considera un nutriente esencial porque puede sintetizarse gracias a los aminoácidos L-cisteína, ácido L-glutámico y glicina. Además, su proceso de biosíntesis comprende dos pasos principales: (1)
|
Principales utilidades del glutatión
A continuación veremos las principales utilidades del glutation.
Glutatión en las plantas
La principal función del GSH en las plantas es equilibrar el estrés biótico y abiótico, además de reducir el peróxido de hidrógeno venenoso que participa en el ciclo de glutatión-ascorbato.
Para que las plantas tengan una protección eficaz contra patógenos como Pseudomonas syringae y Phytophthora brassicae, es necesaria la presencia del glutatión.
Además, existen enzimas oxidorreductasas de las plantas que contienen este tripéptido y participan en el desarrollo de flores, ácido salicílico y en las señales de defensa de la planta.
Glutatión en las uvas
En el año 1989 fue cuando se encontró GSH en las uvas, tanto de las bayas como de los mostos correspondientes de las 28 variedades de uva pertenecientes a Vitis vinifera. Este contenido se cuantificó y era variable en función de la variedad de la uva que se tratase, desde 56-372 mol / kg (17-114 mg / kg). (1)
Durante todas las investigaciones que se han ido realizando sobre el contenido de GSH, se ha observado durante el inicio del proceso de maduración bayas de Vitis vinifera va aumentando, sobre todo, en las variedades blancas, tintas, sin semillas y con semillas. (1)
Presencia en mostos y vinos: papel en la elaboración y Saccharomyces cereviseae
Este compuesto está presente de forma natural en la uva y ejerce un papel vital en la oxidación de mostos blancos, atrapando orto-quinonas con el objetivo de evitar una pigmentación parda formada durante la oxidación, además de participar en la protección de los compuestos responsables del aroma del vino. (1)
Por otra parte, en la levadura Saccharomyces cereviseae, GSH se encuentra en concentraciones de hasta 10 mM, ya que es necesaria para producir GSH industrialmente mediante fermentación. (1)
El pardeamiento que se produce en el proceso oxidativo de la vinificación de vino, hace que pierda sus propiedades sensoriales, es decir, de sus cualidades organolépticas:
- Pérdida del color: aumento del color amarillo y pardo y pérdida del color rojizo característico del vino.
- Pérdida del aroma: deterioro del aroma varietal, destacando el contenido en etanal libre,

A continuación, veremos dos tablas que resumen algunos alimentos ricos en esta substancia y su contenido aproximado:
Tabla 1: Alimentos ricos en glutation
|
Alimento |
Contenido en (mg) |
|---|---|
| Espárragos | 28 |
| Aguacate | 19 |
| Naranjas | 15 |
| Brócoli | 26 |
Tabla 2: Beneficios del glutation para los deportistas
|
Beneficio |
Descripción |
|---|---|
| Mejora de la función antioxidante | El glutation ayuda a neutralizar los radicales libres generados durante el ejercicio intenso, reduciendo el daño oxidativo en los tejidos musculares. |
| Aumento de la resistencia al ejercicio | El glutation contribuye a una mayor eficiencia energética y a una menor acumulación de lactato durante el ejercicio prolongado. |
Asociaciones del glutatión con algunas enfermedades
A continuación os mostramos asociaciones del glutation, con ciertas enfermedades.
Glutatión reductasa (GRd): Cáncer, Diabetes Mellitus, Obesidad, Enfermedad de Parkinson, Isquemia, Úlcera péptica
Cáncer
Se han hecho varios estudios sobre el comportamiento de esta substancia reductasa en las células tumorales y se ha llegado a la conclusión de que en la metástasis inducida por la hidroxiurea depende de un proceso que requiere de GSH.
Se comprobó que la hidroxiurea atrae la resistencia al H2O2 debido a la inducción del GSH y su actividad antioxidante, ya que la eliminación de esta resistencia revierte la capacidad de metástasis.
En concreto, las células que fueron tratadas con hidroxiurea resultaron ser más metastásicas y resistentes al H2O2, además en estas células la actividad de la glutation reductasa y oxidasa, así como los niveles de GSH fueron mayores. (2)
Por tanto, el papel de esta enzima antioxidante en las células tumorales, en concreto la melanima B16, hace que se incremente el proceso metastásico y la respuesta celular a la quimioterapia.
Diabetes Mellitus
La glicación es un proceso biológico que se produce de una forma bastante común en la diabetes. Por tanto, se ha relacionado la GRd con la Diabetes Mellitus.
Esta enzima puede ser glicosilada y alterar su actividad, debido a que tanto la glucosa, como la glucosa 6-fosfato y la fructosa inhiben la actividad de la enzima.
Consecuentemente, se produce la formación de cataratas en pacientes con diabetes. No obstante, algunos medicamentos como la aspirina pueden ser utilizados para prevenir la glicosilación de la GRd. (2)
Obesidad
Existe la hipótesis de que el consumo de dietas ricas en grasa disminuye o dificulta la actividad de la GRd, además de la glutatión oxidasa, tanto en el corazón como en otros órganos vitales para evitar problemas cardiovasculares. (2)
Por ello, se han realizado diversos estudios en conejos con una dieta aumentada en lípidos, debido a la cual se produjo una depresión de la actividad de la GRd y oxidasa, dependiente del selenio y viéndose asociada con un aumento de compuestos tioles no proteicos.
Este estudio permitió concluir que dietas elevadas en grasas y colesterol provocan un desequilibrio de la protección antioxidante de estas enzimas, y como consecuencia, un aumento de la peroxidación lipídica. (2)
Enfermedad de Parkinson
El desarrollo de esta enfermedad es debido a una disminución de las concentraciones de GSH en la sustancia negra del cerebro. Se ha mostrado que la consecuencia es un aumento del recambio de la dopamina y la desaminación oxidativa que forma la producción de peróxido de hidrógeno. (2)
Úlcera péptica
El contenido de GSH y la actividad de sus respectivas enzimas que participan en los procesos de oxidación y reducción fue estudiada en un ensayo en ratas con úlceras inducidas en el tejido hepático y la mucosa gástrica. El resultado del ensayo mostró una disminución de la actividad enzimática del glutation. (2)
Isquemia
El indicador del estrés oxidativo que se produce por la formación de radicales libres de oxígeno lo determina los estados de oxidacción/reducción de esta substancia en un órgano isquémico.
Por esta razón, se han realizado estudios en los que se ha inducido una isquemia temporal al corazón, y se ha obtenido una estimulación de las enzimas antioxidantes, lo que resulta ser que el precondicionamiento de un corazón que sufre de isquemia repetida puede favorecer el aumento de protección oxidativa mediante las enzimas correspondientes del glutation.
Por tanto, estas enzimas pueden ayudar a evitar daños en el miocardio derivados de una isquemia y reperfusión. (2)
Alimentos que contienen glutation
Esta substancia se encuentra en gran cantidad en alimentos que contienen una alta concentración de azufre, derivada del aminoácido cisteína que participa en su formación, dentro en su composición nutricional. Por tanto, entre estos alimentos se incluyen: (3)
- Huevos
- Carne blanca
- Legumbres (soja)
- Cereales
- Hongos, como champiñones o setas
- Frutos secos
También, podemos encontrar este tripéptido en una gran variedad de frutas y verduras crudas: (3)
- Espinacas
- Col
- Aguacate
- Calabaza
- Esparragos
- Sandía
- Fresa
- Naranja
- Toronja
- Cebolla
Además, como ya hemos mencionado previamente en el apartado de las principales utilidades del glutation, también se encuentra de forma natural en la uva, y por tanto, en mostos y vinos. (1)
Conclusiones
Como conclusión final de este artículo podemos decir que tanto el glutation como sus respectivas enzimas, en concreto, la glutation reductasa, juegan un papel fundamental en el funcionamiento de las células, debido a las siguientes razones:
|
Referencias bibliográficas
- Tabanera, Mª A. (2015). El glutatión. Universidad Nacional de Cuyo. Facultad de Ciencias Aplicadas a la Industria; págs: 1-245
- Cisneros Prego, E. (1995). La glutation reductasa y su importancia biomédica. Revista cubana de investigaciones biomédicas, 14(1), 0–0.
- Gutman, Dr. J.(2019). La Guía Completa del Glutatión, 5ª edición. Investigación y aplicaciones clínicas; págs: 354.