El consumo de proteína en polvo se ha convertido en un hábito entre ambos deportistas de élite y deportistas amateur, una moda promovida por empresas deportivas y medios de comunicación, incluyendo prensa deportiva. Y, de hecho, todavía no conocemos los efectos a largo plazo que puede suponer este comportamiento para la salud.
Debido al daño que infligen en su musculatura por el entrenamiento extenuante al que se someten, los atletas profesionales pueden requerir un aporte nutricional más elevado que la media de la población. Sin embargo, los batidos de proteínas pueden ser innecesarios o, incluso, peligrosos en el sector del fitness.
En el ámbito deportivo amateur, el entrenamiento raramente se mide de manera cuantitativa y los requerimientos nutricionales reales (incluyendo proteínas, carbohidratos, grasa y agua) son desconocidos.
Para clarificar, las proteínas son (i) cadenas de aminoácidos o clústeres de dichas cadenas (ii) con una estructura particular, (iiii) que les confiere la funcionalidad. Intervienen en la renovación de tejidos, reacciones inmunológicas, actividad enzimática, transporte de sustancias y producción de energía.
Los adultos requieren no más de 0.8 a 0.9 gramos de cantidad de proteína por quilogramo de masa corporal cada día para satisfacer las necesidades proteicas. De hecho, los requerimientos siguen una distribución normal, necesitando la mayoría de la población solamente 0.66 g/kg·dia (1). Siguiendo los datos de la EFSA (European Food Safety Autorithy) del 2015, las necesidades de proteínas en la población europea son de 0.83 g/kg·día para adultos y ancianos sanos (2) (Figura 1).

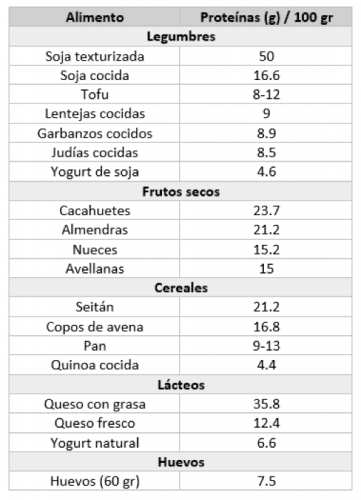
Para ofrecer una idea del contenido real de proteínas en los alimentos, la Tabla 1 muestra la cantidad de proteína por 100 gramos de diferentes productos, reportado por la USDA (United States Department of Agriculture) (3) .
La Tabla 2 ofrece un ejemplo de la ingesta proteica adecuada para una persona de 75 kg de peso, las necesidades de proteína diarias de la cual son de 62.88 gramos.
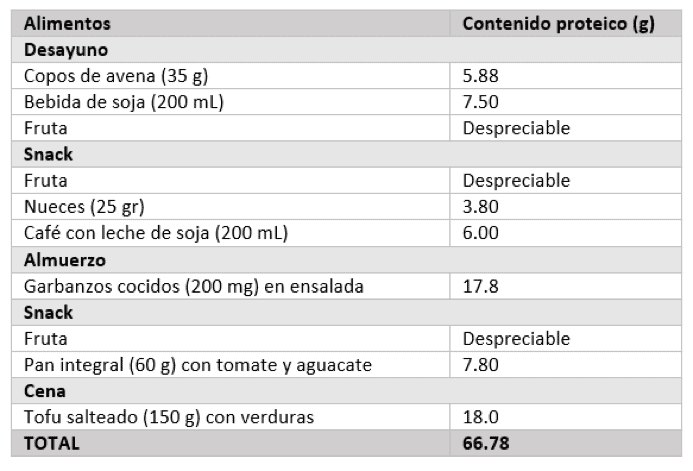
La ingesta calórica total, sin embargo, no ha sido ajustada, dado que dependerá de las demandas energéticas y la actividad física particular. A mayor masa muscular una persona posee, más grandes serán las porciones y, por lo tanto, el contenido de proteínas se incrementará de manera proporcional.
Es de gran importancia incluir una cantidad de proteínas de alta calidad en las ingestas principales (Tabla 3).

No obstante, la tasa de digestibilidad difiere entre alimentos, hecho que cabe considerar en el cálculo de la ingesta proteica en la dieta (consulta PDCAASs, Protein Digestibility-Corrected Amino Acid Scores) (4).
La digestibilidad proteica se define como la habilidad de nuestro tracto digestivo de absorber la cantidad de proteínas que contienen los alimentos.
En general, las proteínas vegetales tienen una digestibilidad menor que las proteínas de origen animal, debido a la necesidad de romper la pared celular durante el proceso de digestión4. Esto no aplica a los productos derivados de la soja, con una digestibilidad equivalente a la de los alimentos proteicos animales (4).
Además, los productos vegetales contienen fitatos y taninos (i.e. antinutrientes), los cuales dificultan la absorción de determinados componentes, incluyendo las proteínas y la fibra. Métodos como el remojo, la germinación y la cocción aumentan la digestibilidad y contrarrestan la acción de los antinutrientes (5).
Y, a pesar de la menor digestibilidad de las proteínas de origen vegetal, los alimentos vegetales son igualmente capaces de cubrir los requerimientos proteicos diarios (6) .
Cabe tener en cuenta que los requerimientos proteicos basales pueden incrementarse en dietas vegetales que excluyen la soja y sus derivados, hasta valores de 1 o 1.1 gramos de cantidad de proteína por quilogramo de masa corporal (7).
La preocupación popular sobre la ingesta proteica ha dado lugar a la sobredosis en el contenido proteico de las dietas occidentales, normalmente proviniendo de fuentes animales.
Un exceso en las recomendaciones proteicas concluye en un conjunto de efectos adversos para la salud que incluyen (i) alteraciones en homeostasis del hueso y el calcio, (ii) alteraciones en la función de riñones e hígado, (iii) aumento del riesgo de cáncer, y (iv) una progresión precipitada hacia enfermedades coronarias.
Así, es interesante cuestionarse si la reciente tendencia del consumo de batidos de proteínas en fitness puede, cuando no es necesario, aumentar el riesgo o aparición de las condiciones anteriores. De hecho, se ha detectado un aumento de enfermedad crónica en riñón en la población (prevalencia de 1/8 en EEUU) (8), siendo ¾ de los afectados inconscientes de que sus riñones empiezan a fallar (9).
A modo ilustrativo, una dieta occidental rica en carne y azúcares – que exceda en ambos proteínas y grasa animal, y azúcar- causa, a parte de otros problemas en la salud, un rápido declive en la función de los riñones, inflamación y microalbuminuria, una alteración de la estructura del riñón, un aumento en la carga ácida de la dieta y el subsiguiente aumento compensatorio en la excreción de ácido por los riñones y la producción de amoniaco; conduciendo a un estado de acidosis metabólica y un mayor riesgo de enfermedad tubulointersticial (10).
Dado esto, la ingesta restringida de proteínas se recomienda para la prevención de las piedras recurrentes en el riñón y la progresión del declive en las funciones del mismo (10).
Pero, la fuente proteica es capital en el proceso, siendo más relevante que la cantidad de proteína en sí misma. Diversos estudios han demostrado que la administración de una cantidad de proteína equivalente para alimentos vegetales no produce ningún efecto perjudicial en los riñones (11).
La carne aumenta la carga en los riñones durante las horas posteriores al consumo, un efecto que las proteínas de origen vegetal no producen (13) (Figuras 2 y 3).
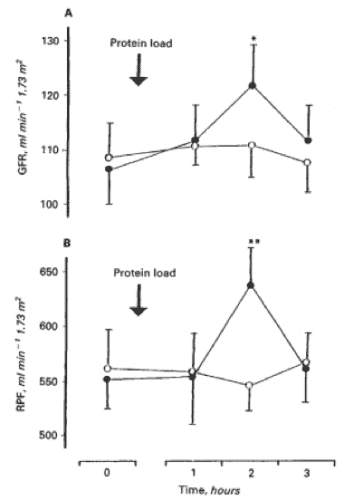
individuos sanos (1,2, 7).
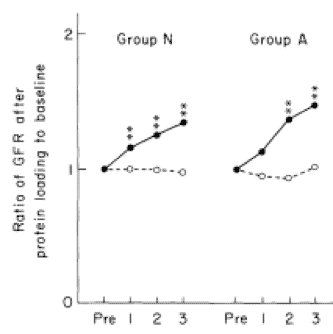
El consumo de soja, en lugar de proteínas de origen animal, se asocia con un menor hiperfiltrado y albuminuria; ralentizando el deterioro de la función renal (14).
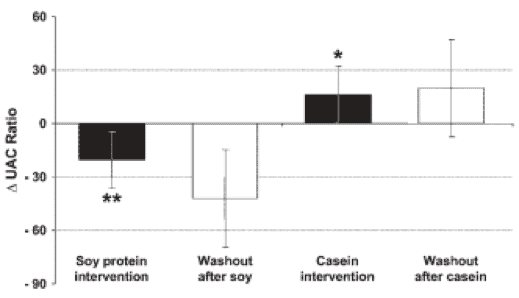
Es más, la soja tiende a preservar la funcionalidad en comparación a los placebos lácteos (14). Tan solo la administración de proteína de soja aislada mejora el perfil lipídico en suero en hombres con diabetes tipo 2, en comparación a la administración de caseína (15) (Figura 4).
Por último, la sobrecarga renal producida por las proteínas animales, pero no vegetales, se considera la consecuencia del efecto inflamatorio que los alimentos de origen animal inducen en el organismo (16); temática que requiere otro artículo independiente para ser suficientemente desarrollado.
Desde un enfoque más profundo, la ingesta de cantidad de proteína conduce a los riesgos para la salud antes mencionados a través de la producción de la hormona IGF-I (Insulin Growth Factor I). Simplificando, cuando se consume cierta cantidad de proteína, el hígado recibe la señal de crear componentes corporales y, por lo tanto, libera IGF-I (17).
Pero el crecimiento celular en adultos es un factor que queremos aminorar, de no ser así podría provocar el crecimiento celular tumoral< (18). Tal y como se ha mencionado con anterioridad, no solamente la cantidad de proteína se ha de tener en cuenta, sino que la fuente es primordial.
Los estudios que estratifican por fuente de proteínas, encuentran que las personas en una dieta vegetal (i.e. dieta vegana) tienen niveles significativamente inferiores de IGF-I circulante, cuando se compara con los consumidores de proteínas de origen animal; incluso cuando ambas dietas contienen la misma cantidad de proteínas (19).
A modo ilustrativo, una cohorte de individuos que había seguido una dieta vegana durante los últimos 14 años mostraron la mitad de los niveles de IGF-I que una cohorte paralela que seguía una dieta americana estándar; pero poseían el doble de niveles de proteínas de unión a IGF-I (20). Unos cuantos días siguiendo una dieta saludable basada en vegetales y caminando hace que los niveles de IGF-I disminuyan y se detenga el crecimiento tumoral (19).
Aunque el exceso de crecimiento sólido no es bueno en la vida adulta, un poco de crecimiento extra se ha convertido en deseable en la escena del fitness. ¿Intervienen los niveles bajos de IGF-I, causados por un consumo de cantidad de proteína controlado, en la acumulación de masa muscular?
Las evidencias científicas hasta la fecha de experimentos con (i) población que padece gigantismo21, (ii) inyecciones de IGF-I (22) y (iii) modelos de ratones knock-out (i.e. ratones que carecen de IGF-I) (23), muestran que no hay relación entre los niveles de IGF-I circulante y la cantidad de masa muscular. Así, no hay evidencia que unos niveles bajos de IGF-I dificulten el crecimiento muscular.
Concluyendo, una adecuada ingesta proteica (i.e. ajustada por masa corporal y actividad física) es altamente recomendada para evitar consecuencias para la salud que provoca el exceso de proteínas, incluyendo alteraciones en esqueleto, funciones renales y del hígado, cáncer y enfermedad coronaria.
Estas condiciones parecen estar mediadas por los niveles de la hormona IGF-I circulante, producidos por el hígado. Además, no hay evidencia que los niveles bajos de IGF-I, inducidos por una dieta con consumo de cantidad de proteína controlado, interfieran en la acumulación de masa muscular.
El uso de suplementación proteica es una decisión personal. Sin embargo, es capital para la salud del individuo evitar la sobredosis proteica y escoger fuentes de proteína vegetales.
El cálculo de requerimientos proteicos y de la ingesta a través de la dieta, haciendo uso de bases de datos y herramientas oficiales, puede ser de gran utilidad para alcanzar dicho fin.
Referencias bibliográficas
- Millward, D. J. (2007). Identifying recommended dietary allowances for protein and amino acids. Br. J. Nutr. 108, S3–S21.
- EFSA (2012). Scientific Opinion on Dietary Reference Values for protein. EFSA J. 10, 2557.
- Food Composition Databases Show Foods List. Available at: https://ndb.nal.usda.gov/ndb/search/list?fgcd=Branded+Food+Products+Database&ds=Branded+Food+Products. (Accessed: 24th February 2017)
- Schaafsma, G. (2000). The protein digestibility-corrected amino acid score. J. Nutr. 130, 1865S–7S.
- Martínez Argüelles, L. (2016). Vegetarianos con ciencia. Arcopress
- Marsh, K. A., Munn, E. A. & Baines, S. K. (2013). Protein and vegetarian diets. Med. J. Aust. 199, S7–S10.
- Protein. Available at: http://veganhealth.org/articles/protein#rec. (Accessed: 26th February 2017)
- Coresh, J. et al. (2007). Prevalence of Chronic Kidney Disease in the United States. JAMA 298, 2038.
- Ryan, T. P., Sloand, J. A., Winters, P. C., Corsetti, J. P. & Fisher, S. G. (2007). Chronic Kidney Disease Prevalence and Rate of Diagnosis. Am. J. Med. 120, 981–986.
- Odermatt, A. (2011). The Western-style diet: a major risk factor for impaired kidney function and chronic kidney disease. AJP Ren. Physiol. 301, F919–F931.
- Soroka, N. et al. (1998). Comparison of a vegetable-based (soya) and an animal-based low-protein diet in predialysis chronic renal failure patients. Nephron 79, 173–80.
- Kontessis, P. et al. (1989). Renal, metabolic and hormonal responses to ingestion of animal and vegetable proteins. Kidney Int. 38, 136–144 (1990).
- Nakamura, H. et al. Effects of acute protein loads of different sources on renal function of patients with diabetic nephropathy. Tohoku J. Exp. Med. 159, 153–62.
- Liu, Z., Ho, S. C., Chen, Y., Tang, N. & Woo, J. (2014). Effect of whole soy and purified isoflavone daidzein on renal function—a 6-month randomized controlled trial in equol-producing postmenopausal women with prehypertension. Clin. Biochem. 47, 1250–1256.
- Teixeira, S. R. et al. (2004). Isolated soy protein consumption reduces urinary albumin excretion and improves the serum lipid profile in men with type 2 diabetes mellitus and nephropathy. J. Nutr. 134, 1874–80..
- Fioretto, P. et al. (1990). Impaired renal response to a meat meal in insulin-dependent diabetes: role of glucagon and prostaglandins. Am. J. Physiol. 258, F675-83.
- Ketelslegers, J. M., Maiter, D., Maes, M., Underwood, L. E. & Thissen, J. P. (1995). Nutritional regulation of insulin-like growth factor-I. Metabolism. 44, 50–7.
- Kleinberg, D. L., Wood, T. L., Furth, P. A. & Lee, A. V. (2009). Growth Hormone and Insulin-Like Growth Factor-I in the Transition from Normal Mammary Development to Preneoplastic Mammary Lesions. Endocr. Rev. 30, 51–74.
- Allen, N. E. et al. (2002). The associations of diet with serum insulin-like growth factor I and its main binding proteins in 292 women meat-eaters, vegetarians, and vegans. Cancer Epidemiol. Biomarkers Prev. 11, 1441–8.
- Ngo, T. H., Barnard, R. J., Tymchuk, C. N., Cohen, P. & Aronson, W. J. (2002). Effect of diet and exercise on serum insulin, IGF-I, and IGFBP-1 levels and growth of LNCaP cells in vitro (United States). Cancer Causes Control 13, 929–35.
- Freda, P. U. et al. (2009). Skeletal muscle mass in acromegaly assessed by magnetic resonance imaging and dual-photon x-ray absorptiometry. J. Clin. Endocrinol. Metab. 94, 2880–6.
- Friedlander, A. L. et al. (2001). One Year of Insulin-Like Growth Factor I Treatment Does Not Affect Bone Density, Body Composition, or Psychological Measures in Postmenopausal Women. J. Clin. Endocrinol. Metab. 86, 1496–1503.
- West, D. W. D. et al. (2010). Elevations in ostensibly anabolic hormones with resistance exercise enhance neither training-induced muscle hypertrophy nor strength of the elbow flexors. J. Appl. Physiol. 108, 60–67 .
ROSANA CORTÉS GARRIDO. Estudiante del Máster de Entrenamiento deportivo, Actividad Física y Salud. Facultad de Psicología, Ciencias de la Educación y Deporte Blanquerna – Universidad Ramón Llull.

