En este artículo analizamos las miokinas y su relación con el metabolismo. Son de sobra conocidos los beneficios obtenidos mediante la adaptación del organismo a la práctica de ejercicio.
Sin embargo, no lo son tanto los mecanismos moleculares y fisiológicos detrás de esa respuesta de adaptación. Mucho se podría discutir a este respecto, como muchos son los tejidos y órganos involucrados, pero en esta ocasión nos centraremos en lo que ocurre en el músculo esquelético.
El músculo esquelético es un tejido con una gran capacidad de adaptación, capaz de responder a situaciones de estrés metabólico producidas por un estrés locomotor previo.
Dependiendo de ese estrés locomotor producido: tipo, intensidad, duración, volumen, frecuencia y progresión del entrenamiento; diferentes adaptaciones tendrán lugar no sólo en el músculo sino en todo el organismo. Sin embargo, a día de hoy se desconoce el punto de partida de muchos de los procesos metabólicos que se activan en diversos órganos y tejidos a consecuencia del ejercicio.
Recientemente, se ha descubierto un nuevo grupo de moléculas que podrían ser capaces de comunicar al músculo con otros tejidos u órganos, son las denominadas miokinas (23).
Una perspectiva histórica
La idea de que las células del músculo esquelético puedan producir y secretar factores humorales no es nueva.
A mediados de siglo XX, Goldstein ya especuló con la posibilidad de que el músculo esquelético, a consecuencia de repetidas contracciones producidas durante el ejercicio, pudiera liberar al torrente sanguíneo una serie de “factores humorales” o “factores de ejercicio” capaces de comunicar al propio músculo con otros órganos o tejidos (por ejemplo, tejido adiposo, el hígado, cerebro, etc.) y así controlar la glucemia independientemente de la insulina.
A día de hoy sabemos que el control de la glucemia no se debe a un único factor, pero no por ello la hipótesis de que el músculo esquelético pudiera actuar como un órgano secretor ha sido descartada, si bien ha permanecidos en estado latente, hasta que Pedersen et al. relanzaron la búsqueda de los llamados “factores de ejercicio” con su estudio sobre la interleucina-6, que conllevó la identificación de otros factores durante la pasada década.
Entonces, ¿qué son las Miokinas?
La aportación de Pedersen et al. (23) fue más allá, ya que además dieron forma a la hipótesis del músculo como órgano secretor.
Observaron que el músculo esquelético era capaz de producir y liberar una gran variedad de factores, fundamentalmente péptidos y citocinas, que actuaban de manera endocrina comunicando el músculo con otros tejidos alejados, así como de manera auto-paracrina, en otras palabras localmente en el propio músculo o en tejidos próximos.
Así pues, se dejo atrás el término “factores de ejercicio”, que fue sustituido por el de miokinas, para hacer referencia a: “citocinas y péptidos producidos, expresados y liberados por las fibras del músculo esquelético como consecuencia de contracciones musculares repetidas provocadas por el ejercicio, que ejercen mecanismos de comunicación endocrina, paracrina y/o autocrina con otros tejidos u órganos” (20, 23).
¿Qué importancia tienen?
Estudios como el de Catoire et al., en el cual pudo observarse cómo tras una sesión de entrenamiento de resistencia se produjeron cambios en la expresión génica de músculos que no fueron ejercitados, no hacen sino poner de manifiesto la relevancia de factores circulantes y/o locales capaces de activar, modificar o inhibir procesos moleculares básicos de adaptación al ejercicio.
Y es aquí donde las miokinas juegan un papel fundamental, ya que se cree que podrían establecer una red de comunicación molecular, con origen en el músculo esquelético, de una relevancia difícil de calcular. Si bien cabe destacar que además de las miokinas existen otros actores que formarían parte de esa red de comunicación establecida a consecuencia del ejercicio, adipokinas o hepatokinas por ejemplo.
A continuación, se muestra una selección de miokinas y la comunicación que establecen con otros órganos y tejidos (Figura 1).
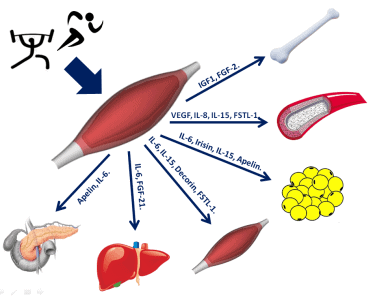
- Músculo – Masa Ósea. El factor de crecimiento insulínico tipo 1 (IGF-1) o el factor de crecimiento de fibrablasto 2 (FGF-2) parecen influir sobre la osteogénesis o formación ósea (10).
- Músculo – Aparato Circulatorio. El factor de crecimiento endotelial vascular (VEGF), la interleucina-15 (IL-15), o la folistatina tipo 1 (FSTL-1) estimulan la angiogénesis y el mantenimiento de las funciones del endotelio (29).
- Músculo – Tejido Adiposo. La interleucina-6 (IL-6), IL-15, la irisina y la apelina han sido relacionadas con un aumento de la lipólisis y disminución de la acumulación de adipocitos, así como con la transformación de los adipocitos blancos en pardos (“browning”) en el caso de la irisina.
- Músculo – Músculo. Relacionados con procesos de hipertrofía muscular han sido IL-6, IL-15, decorin y FSTL-1.
- Músculo – Hígado. El factor de crecimiento de fibroblastos 21 estimula la oxidación de ácidos grasos y la gluconeogénesis (24) , mientras que la IL-6 estimula el aumento de la producción de glucosa y glucógeno.
- Músculo – Páncreas. Se ha relacionado a la IL-6 con el aumento de la proliferación de células beta (7), y a la apelina con la secreción de insulina (1).
Como se ha comentado, estas son sólo una selección de miokinas y un pequeño ejemplo de la red de comunicación que establecen con otros órganos o tejidos. Sin embargo, nos permiten apreciar la relevancia de su función en los procesos de adaptación metabólica al ejercicio.
En consecuencia, estás moléculas han ido adquiriendo cada vez una mayor importancia no solo en el campo de la fisiología del ejercicio aplicadas al rendimiento, sino también aplicadas a la salud, dada su implicación en patología tales como la obesidad, la diabetes, la sarcopenia o incluso el cáncer.
Finalmente, cabe destacar que el correcto funcionamiento de esta red de comunicación está supeditado a la práctica de ejercicio físico. Es más, se cree que periodos prolongados de inactividad física provocan una reducción no sólo de la masa muscular neta sino de la actividad biológica del propio músculo esquelético.
En consecuencia, se produciría una reducción en la producción y secreción de miokinas. Cuando esto ocurre, otros tejidos podrían tomar el relevo y actuar como sustitutos, encargándose de producir estas moléculas; no obstante, sus funciones no serían necesariamente las mismas, pudiendo incluso cambiar radicalmente, convirtiéndose en perjudiciales para el organismo (22).
¿Cuál es el futuro de las miokinas?
Actualmente, han sido identificadas alrededor de unas 500 miokinas diferentes (11, 26), muchas de las cuales siguen sin ser caracterizadas. Además, la identificación de esas miokinas se ha realizado en ocasiones a partir de tejido muscular no ejercitado (2), por lo que la posibilidad de falsos negativos no es descartable, y por tanto tampoco la existencia de muchas otras miokinas esperando a ser detectadas.
A pesar de todo ello, no son pocos los que dudan de la relevancia de las miokinas. El argumento a favor de esta discrepancia se basa, esencialmente, en las diferencias entre modelos animales y humanos, concretamente en el “profundo” conocimiento que se posee en relación a algunas miokinas y las altas respuestas de estas al ejercicio en modelos animales, en comparación al escaso conocimiento y limitada respuesta en humanos.
Por ello, parece necesario llevar a cabo más estudios en humanos para entender la función y el funcionamiento de estas interesantes moléculas, así como sus efectos en las adaptaciones metabólicas al ejercicio.
Sin olvidarnos de que el músculo esquelético está fundamentalmente preparado para producir proteínas (15), por lo que la producción y secreción, aunque sea en pequeñas cantidades, de factores reactivos por parte de uno o varios músculos podrían producir un gran efecto local o sistémico que podría ser básico en los procesos de adaptación al ejercicio y a su vez en los beneficios sobre la salud de estas adaptaciones.
Claves
- Las miokinas son, péptidos y citocinas, liberados por el músculo esquelético a consecuencia del ejercicio y que establecen una red de comunicación con otros tejidos.
- Han sido relacionadas con importantes procesos de adaptación metabólica al ejercicio.
- La importancia de la correcta producción y liberación de miokinas podría ser básica en patologías tales como la obesidad, la diabetes o la sarcopenia.
A continuación nos centraremos en aquellas miokinas que juegan un papel importante en procesos de prevención y reversión del síndrome metabólico (11), y especialmente en aquellas con efecto sobre la resistencia a la insulina (parte I) y la inflamación (parte II).
Inactividad Física
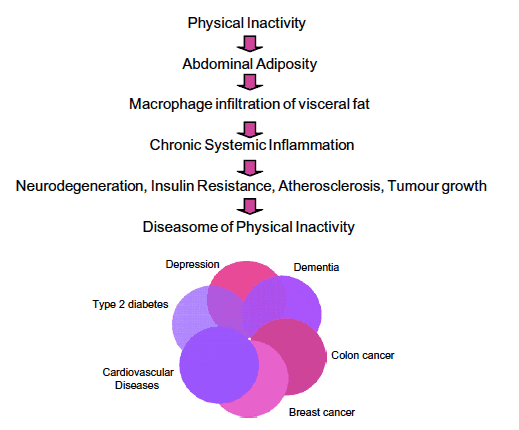
A día de hoy pocos son los que cuestionan el papel de la inactividad física como factor de riesgo para el desarrollo de enfermedades metabólicas como la obesidad y la diabetes (23) (Figura 1). Diversos son los estudios que apoyan está idea, pero quizá por impactante mencionaremos el realizado por Alibegovic et al. (3) en el cual tras únicamente 9 días de reposo en cama se observó como n adultos sanos se producia una modificación en la expresión de más de 4.500 genes, al mismo tiempo que una disminución en la expresión del 54% de los genes asociados a la fosforilación oxidativa que es un proceso básico para que la célula muscular obtenga energía en forma de ATP.
La atrofia muscular es otro de los efectos observados a consecuencia de la inactividad física, y es que a falta de contracciones musculares y de ejercicio en el músculo se activan mecanismo fisiológicos de destrucción, mecanismos catabólicos, que no sólo provocan una destrucción de músculo sino que también reducen la actividad biológica del mismo, y por tanto reducen los beneficios que las miokinas producen sobre procesos metabólicos en el organismo. Así pues, a continuación mostramos las implicaciones de algunas miokinas sobre diferentes procesos metabólicos con un nexo de unión común, la reversión del síndrome metabólico.
Miokinas en el metabolismo de la glucosa
Interleucina-6 (IL-6)
Incrementos temporales de la IL-16 provocan beneficios sobre la captación de glucosa por parte del músculo, la mejora de la tolerancia a la glucosa, la translocación del GLUT4, la síntesis de glucógeno y la sensibilidad a la insulina (2, 16, 22, 29), estando asociados algunos de estos beneficios a incrementos de la leptina (29), hormona relacionada con la saciedad y el aumento del metabolismo basal. Una única sesión de entrenamiento de resistencia parece ser estímulo suficiente para producir tales aumentos temporales de la IL-6, siempre y cuando la duración e intensidad de esa sesión sean elevados (34).
También el estatus energético del músculo antes y durante del ejercicio pueden variar la respuesta de la IL-6, pues la ingesta de hidratos de carbono durante el ejercicio inhibe la producción de IL-6 (14), mientras que bajos niveles de glucógeno muscular pre-ejercicio aumentan la respuesta de estas miokinas (18, 33), lo que sugiere que el entrenamiento en ayunas puede resultar interesante de manera ocasional en pos de estas mejoras metabólicas. No es de extrañar, por tanto, que si elevados niveles de glucosa en sangre producen una inhibición de la IL-6 en respuesta al ejercicio, en población diabética la respuesta de estas miokinas al entrenamiento este disminuida, si bien se cree que en respuesta a un programa de entrenamiento podría revertir dichos efectos (16).
Interleucina-13 (IL-13)
Más reciente y menos estudiada es la Interleucina-13 (IL-13); sin embargo su implicación en el metabolismo de la glucosa parece ser también clara, siendo crucial en la oxidación y síntesis de glucógeno (17), además de mediar en la producción hepática de la glucosa durante el ejercicio (32). Por ello, y porque en población diabética los niveles de esta IL-13 son in 75% inferiores comparadas con población sana (17), estas miokinas acaparará mucha atención tanto de investigadores como de profesionales de la salud y el deporte en el futuro.
Miokinas en el metabolismo de los ácidos grasos
Fundamentalmente cuatro son las miokinas que se ha observado tiene efectos importantes sobre el metabolismo de los ácidos grasos: La IL-6, la interleucina-15 (IL-15), el factor neurotrófico derivado del cerebro (BDNF) y la Irisina.
Miokinas: Interleucina-6 (IL-6)
En respuesta una sesión de entrenamiento de resistencia el incremento de los niveles de IL-6 provoca un aumento de la lipólisis y la oxidación de acidos grasos (36). Sin embargo, estos efectos parece ocurrir principalmente a nivel local, en el propio músculo, pues no se han observado efectos el tejido adiposo (37).
Miokinas: Interleucina-15 (IL-15)
La IL-15 por contra, no sólo parece producir efectos a nivel local sino también a nivel sistémico afectando al tejido adiposo (26). Entre estos efectos encontramos el incremento de la lipólisis y la angiogénesis (formación de nuevos vasos sanguíneos), la reducción de la acumulación de adipocitos (células grasa) y la mejora de la resistencia de la insulina por medio de la mayor producción de la adiponectina (1, 4, 8, 26, 27).
Factor neurotrófico derivado del cerebro (BDNF)
Aunque el BDNF es originado en su mayoría en el cerebro en respuesta al ejercicio (28), se cree que también podría serlo por el músculo esquelético con efectos sobre la lipolisis (21), y quizá también con procesos relacionados con el desarrollo de la diabetes (19).
Irisina
Por último, en 2012, Boström et al. (6) observaron que en respuesta al entrenamiento de resistencia se producía la expresión de varios genes (PGC1-α y posteriormente FNDC5) que a su vez provocaban la liberación a la circulación de una proteína desde la membrana de la célula muscular, la irisina. Mucho fueron los que se interesaron en esta miokina ya que parece mediar de manera importante en procesos de remodelación del tejido adiposo (vía proteína no acoplada 1 o UCP-1) (30, 38) transformando adipocitos blancos en pardos, o dicho de manera más simple transformando la grasa “mala” y biológicamente menos activa en grasa “buena” o biológicamente más activa. La implicación e importancia de este pardeamiento o transformación de la grasa es enorme, ya que además de provocar una disminución del tejido adiposo y un aumento del gasto energético (10, 39) también nos ayudará a entender el comportamiento de nuestro cuerpo cuando es sometido a bajas temperaturas.
Miokinas en la secreción de insulina
Finalmente, en relación a la secrección de la insulina la acción del factor de crecimiento de fibroblastos 21 (FGF-21), la IL-16 y el Péptido similar al Glucagón-1 (GLP-1), la quimioquina C-X3-C motif ligando 1 (CX3CL1), y la apelina parece ser beneficiosa.
Factor de crecimiento de fibroblastos 21 (FGF-21)
Si bien la FGF-21 podría incluirse dentro del apartado del metabolismo de ácidos grasos debido a su rol sobre el pardeamiento de la grasa blanca (7) y a la disminución de los niveles de trigliceridos (9), parece que su acción principal en respuesta al ejercicio se centra en el restablecimiento del equilibrio metabólico por medio de la mejora de la resistencia a la insulina a través del incremento de la adiponectina (20).
IL-6 vía Péptido similar al Glucagón-1 (GLP-1)
Individualmente, la IL-6 protege a las células alfa y beta del páncreas del estrés metabólico (12), pero quizá el efecto más importante de la IL-6 en relación a la insulina sea la estimulación del peptido similar al glucagon-1 o (GLP-1) ya que la producción de este peptido, desde las células del L del intestino y las células alfa del páncreas, mejora la secreción de insulina así como la tolerancia a la glucosa (13, 35).
Quimioquina C-X3-C motif ligando 1 (CX3CL1)
También relacionada con el páncreas encontramos a la CX3CL1 (15). En respuesta a una única sesión de entrenamiento (25) esta miokina parece conectar al musculo y al páncreas protegiendo los islotes pancreáticos (15) que pueden verse dañados a consecuencia del desarrollo de la diabetes y la obesidad (31). Sin embargo, más estudios son necesarios para determinar la importancia de esta quimioquina.
Apelina
Finalmente, Besse-Patin et al. (5) descubrió que tras 8 semanas de entrenamiento de resistencia se producía el aumento de la expresión genética de la apelina, asociándose este aumento a la mejora de la resistencia a la insulina que experimentaron los participantes al completar las semanas de entrenamiento. Aunque también se ha sugerido que puede intervenir en los procesos de pérdida de peso (5) más estudios son necesarios para entender esta miokina.
Después de analizar en anteriores publicaciones la importancia de las miokinas sobre diferentes procesos relacionados con la resistencia a la insulina, a continuación nos centraremos en los efectos de estas moléculas sobre procesos inflamatorios que tienen lugar en el desarrollo del síndorme metabólico (49).
Inflamación, inactividad física y síndrome metabólico.
El desarrollo de hábitos de vida sedentarios y el exceso de ingesta energética generan un incremento de la acumulación de tejido adiposo por todos conocido. Sin embargo, no son tan conocidos procesos inflamatorios como la infiltración de células inmunológicas a nivel local (grasa visceral), ni tampoco los incrementos locales y sistémicos de citocinas y adipokinas que también tiene lugar.
Por este motivo, la obesidad y la diabetes tipo 2 han sido asociadas a procesos inflamatorios (68), mientras que la práctica de actividad física regular se ha presentado como una importante herramienta para combatir los procesos inflamatorios mencionados (65). Prueba de ello es que la practica de actividad física ha mostrado reducir los niveles basales de diversos marcadores inflamatorios (43, 46, 56), mientras que la inactividad física ha producido efectos totalmente contrarios (47, 50).
Para investigar más a fondo si efectivamente la práctica de ejercicio provocaba una respuesta anti-inflamatoria, Starkie et al. (70) analizaron las respuesta inflamatoria que producía la infusión de lipopolisacaridos (o endotoxinas) tras 2,5 horas de ejercicio o descanso. Y efectivamente, observaron un aumento en plasma de TNF-α (factor de necrosis tumoral alfa, reconocido factor inflamatorio) en los participantes que descansaron esas 2 horas y media, mientras que aquellos que realizaron ejercicio se inhibió la expresión de dicho factor inflamatorio.
Si bien la realización de actividad física moderada reduce la inflamación crónica como acabamos de mostrar, la práctica de actividad física vigoroso o de alta intensidad provoca un descenso temporal de diversos factores inmunológicos y un incremento sanguíneo de factores inflamatorios tras la finalización del ejercicio (~3-24h post-ejercicio) (51). Más específicamente, tras un ejercicio muy intenso como una maratón se produce un fuerte aumento de los niveles de TNF-α y de la interleucina-1α (IL-1α) como consecuencia del daño muscular producido por el ejercicio (41, 60). Sin embargo, ha de distinguirse el incremento de estos factores tras un ejercicio extenuante, a aquel que se produce como consecuencia de patologías metabólicas, ya que en respuesta al ejercicio extenuante es necesario ese aumento de citocinas pro-inflamatorias ya que estas favorecerán los procesos de reparación y remodelación de músculo (62).
A pesar de los beneficios mostrados por la actividad física regular sobre procesos inflamatorios en humanos (70) la mayor parte de las evidencias que apoyan la hipótesis del ejercicio como estímulo anti-inflamatorio están basados en estudios sobre modelos animales. Y lo que es mas importante, a día de hoy existe un gran desconocimiento en relación a los mecanismos anti-inflamatorios inducidos por el ejercicio. En la Figura 1 pueden verse algunos de los posibles mecanismo de afectación sistémica (49).
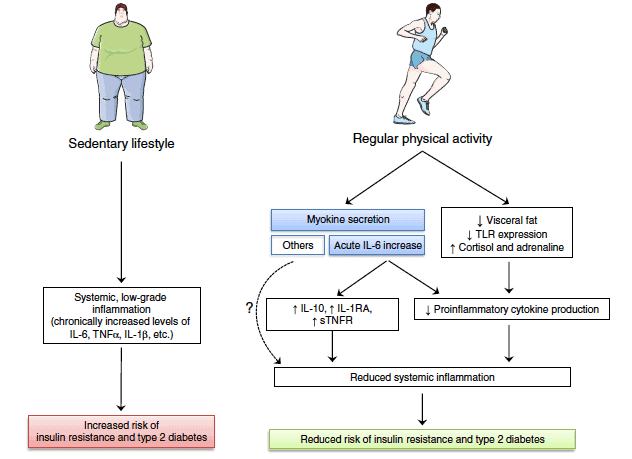
Entre esos posibles mecanismo, las miokinas podrían jugar un papel importante, veamos por qué y cuales.
Miokinas e inflamación
Interleucina-6
Además de los beneficios que el incremento agudo de la IL-6 tiene sobre la resistencia a la insulina y que explicamos en parte I de este artículo, parece que estas miokinas podría ejercer también efectos anti-inflamatorios (63).
Sin embargo, a la hora de analizar esta molécula en sangré, debe tenerse en cuenta el tejido del que proviene, ya que no sólo el músculo puede producir y expresar la IL-6. Por un lado, la acumulación de tejido adiposo visceral genera un aumento en la producción de la IL-6 por parte de este tejido a sangre, el aumento crónico de esta molécula tendrá efectos pro-inflamatorios y por tanto no es de extrañar que en pacientes obesos, con diabetes tipo 2 o resistencia a la insulina se observen valores elevados de IL-6 (44, 58, 55). Por otro lado, en respuesta a ejercicio moderado se producen aumentos agudos de la IL-6 por parte del músculo que en este caso desencadenaran procesos anti-inflamatorios en el organismo (63).
Esta dualidad en la función de la IL-6 dependiente del tejido productor, se debe a los mecanismo de señalización que es capaz de activar la IL-6, por un lado la via del NFκB (57) si es producida por el tejido adiposo y la del Ca2+, células T (54) p38 MAPK (42) y JNK/AP1 (61) si lo es por parte del músculo esquelético.
Por tanto, en respuesta al ejercicio la IL-6 sería expresado a nivel intramuscular activando una cascada de mecanismo anti-inflamatorios que en otras acciones estimularían la producción de citocinas anti-inflamatorias en sangre tales como la interleucina-10 (IL-10), el receptor alfa de la interlecuina-1 (IL-1Rα), así como el receptor del TNF soluble (sTNFR) (54), y la inhibición de otras tales como el TNF-α anteriormente mencionado (49).
IL-6 vía Interleucina-10 (IL-10), receptor alfa de la interleucina-1 (IL-1Rα) y receptor del factor de necrosis tumoral soluble (sTNFR)
Hemos mencionado como en respuesta al ejercicio, el músculo incrementa de manera aguda la producción de IL-6 y a su vez esa IL-6 provoca el aumento de tres citocinas anti-inflamatorias: IL-10, IL-1Rα y sTNFR con interesantes efectos anti-inflamatorios.
La IL-10 actua inhibiendo la producción y acción de citocinas pro-inflamatorias tales como la IL-1α e IL-1β, TNF-α, interleucina-8 (IL-8) y MIPα (26).Por otro lado, el IL-1Rα inhibe la cascada pro-inflamatoria inducida a nivel celular por el receptor beta de la IL-1 (45), mientras que el sTNFR actúa como inhibidor natural del TNF-α (66).
Quitinasa-3 similar a la proteína 1 (CHI3L1)
Inicialmente, esta molécula fue asociada al desarrollo del asma por medio de vías pro-inflamatorias (49), sin embargo muy recientemente se ha observado que también podría ejercer como miokinas (42).
Al igual que ocurría en el caso de la IL-6 los niveles de la CHI3L1 en sangre se encuentran elevados en pacientes con obesidad, diabetes tipo 2 o resistencia a la insulina (48). Sin embargo, en este caso se desconoce si al igual que en el caso de la IL-6 esto se debe a que diferentes tejidos son capaces de producir la CHI3L1 ya que ha día de hoy se desconocen los mecanismo de acción por los cuales estas miokinas son producidas en respuesta al ejercicio. Si bien, Gorgens et al (42) han planteado la posibilidad de que pudiera actuar como factor auto-protector inducido por el músulo para protegerse frente a la acción negativa del TNF-α como la inflamación o la resistencia a la insulina.
Quimioquina (C-X3-C motif) ligando 1 (CX3CL1)
La CX3CL1 aparentemente también actúa bloqueando la resistencia a la insulina provocada por el TNF-α (67), es más parece que los niveles de CX3CL1 no solo reaccionan frente al ejercicio sino también a la mera infusión de TNF-α en sangre (57), si bien en respuesta a la infusión de TNF-α la producción de CX3CL1 sería llevada a cargo tanto por el músculo esquelético como por el tejido adiposo.
Lo que parece claro es que producida por músculo o tejido adiposo, la CX3CL1 está asociada a patologías como la obesidad, diabetes tipo 2 y resistencia a la insulina (59).
Miokina: Folistatina similar 1 (FSTL1)
Si bien la FSTL1 ha sido una miokina eminentemente relacionada a procesos endoteliales y de revascularización de tejidos (41), también ha sido asociado a procesos inflamatorios (53). Concretamente, se ha especulado con la posibilidad de que la secreción de la FSTL1 sea un mecanismo de defensa vascular en respuesta a los efectos pro-inflamatorios de las diversas adipokinas (49).
Conclusiones sobre las miokinas
Para finalizar, podemos decir que a pesar de la escasa bibliografía cada vez está más afianzada la creencia de que en respuesta al ejercicio las miokinas juegan un importante papel en la reversión de la resistencia a la insulina por medio de diversos mecanismo:
- Metabolismo de la glucosa: IL-6 e IL-13.
- Metabolismo de los ácidos grasos: IL-6, IL-15, Irisina y BDNF.
- Secreción de la Insulina: FGF-21, IL-6 via GLP-1, CX3CL1 y Apelina.
En resumen, el incremento de tejido adiposo fundamentalmente a nivel visceral provoca un aumento en la producción de factores pro-inflamatorios asociados al desarrollo de procesos inflamatorios.
Miokinas como la IL-6, CHI3L1, CX3CL1 o FSTL1 liberadas en respuesta a la práctica de actividad física moderada (y regular) son una herramienta útil pare revertir esos procesos inflamatorios y en última instancia combatir patologías asociadas al síndrome metabólico.
Bibliografía sobre las miokinas
- Ajuwon, K. M., & Spurlock, M. E. (2004): Direct regulation of lipolysis by interleukin-15 in primary pig adipocytes. Am J Physiol Regul Integr Comp Physiol, 287(3): R608-611.
- Al-Khalili, L., Bouzakri, K., Glund, S., Lonnqvist, F., Koistinen, H. A., & Krook, A. (2006): Signaling specificity of interleukin-6 action on glucose and lipid metabolism in skeletal muscle. Mol Endocrinol, 20(12): 3364-3375.
- Alibegovic, A. C., Sonne, M. P., Hojbjerre, L., Bork-Jensen, J., Jacobsen, S., Nilsson, E., Faerch, K., Hiscock, N., Mortensen, B., Friedrichsen, M., Stallknecht, B., Dela, F., & Vaag, A. (2010): Insulin resistance induced by physical inactivity is associated with multiple transcriptional changes in skeletal muscle in young men. Am J Physiol Endocrinol Metab, 299(5): 752-763.
- Angiolillo, A. L., Kanegane, H., Sgadari, C., Reaman, G. H., & Tosato, G. (1997): Interleukin-15 promotes angiogenesis in vivo. Biochem Biophys Res Commun, 233(1): 231-237.
- Besse-Patin, A., Montastier, E., Vinel, C., Castan-Laurell, I., Louche, K., Dray, C., Daviaud, D., Mir, L., Marques, M. A., Thalamas, C., Valet, P., Langin, D., Moro, C., & Viguerie, N. (2014): Effect of endurance training on skeletal muscle myokine expression in obese men: identification of apelin as a novel myokine. Int J Obes (Lond), 38(5): 707-713.
- Bostrom, P., Wu, J., Jedrychowski, M. P., Korde, A., Ye, L., Lo, J. C., Rasbach, K. A., Bostrom, E. A., Choi, J. H., Long, J. Z., Kajimura, S., Zingaretti, M. C., Vind, B. F., Tu, H., Cinti, S., Hojlund, K., Gygi, S. P., & Spiegelman, B. M. (2012): A PGC1-alpha-dependent myokine that drives brown-fat-like development of white fat and thermogenesis. Nature, 481(7382): 463-468.
- Camporez, J. P., Jornayvaz, F. R., Petersen, M. C., Pesta, D., Guigni, B. A., Serr, J., Zhang, D., Kahn, M., Samuel, V. T., Jurczak, M. J., & Shulman, G. I. (2013): Cellular mechanisms by which FGF21 improves insulin sensitivity in male mice. Endocrinology, 154(9): 3099-3109.
- Carbo, N., Lopez-Soriano, J., Costelli, P., Alvarez, B., Busquets, S., Baccino, F. M., Quinn, L. S., Lopez-Soriano, F. J., & Argiles, J. M. (2001): Interleukin-15 mediates reciprocal regulation of adipose and muscle mass: a potential role in body weight control. Biochim Biophys Acta, 1526(1): 17-24.
- Coskun, T., Bina, H. A., Schneider, M. A., Dunbar, J. D., Hu, C. C., Chen, Y., Moller, D. E., & Kharitonenkov, A. (2008): Fibroblast growth factor 21 corrects obesity in mice. Endocrinology, 149(12): 6018-6027.
- Cypess, A. M., Lehman, S., Williams, G., Tal, I., Rodman, D., Goldfine, A. B., Kuo, F. C., Palmer, E. L., Tseng, Y. H., Doria, A., Kolodny, G. M., & Kahn, C. R. (2009): Identification and importance of brown adipose tissue in adult humans. N Engl J Med, 360(15): 1509-1517.
- Eckardt, K., Gorgens, S. W., Raschke, S., & Eckel, J. (2014): Myokines in insulin resistance and type 2 diabetes. Diabetologia, 57(6): 1087-1099.
- Ellingsgaard, H., Ehses, J. A., Hammar, E. B., Van Lommel, L., Quintens, R., Martens, G., Kerr-Conte, J., Pattou, F., Berney, T., Pipeleers, D., Halban, P. A., Schuit, F. C., & Donath, M. Y. (2008): Interleukin-6 regulates pancreatic alpha-cell mass expansion. Proc Natl Acad Sci U S A, 105(35): 13163-13168.
- Ellingsgaard, H., Hauselmann, I., Schuler, B., Habib, A. M., Baggio, L. L., Meier, D. T., et al. (2011): Interleukin-6 enhances insulin secretion by increasing glucagon-like peptide-1 secretion from L cells and alpha cells. Nat Med, 17(11): 1481-1489.
- Febbraio, M. A., Steensberg, A., Keller, C., Starkie, R. L., Nielsen, H. B., Krustrup, P., Ott, P., Secher, N. H., & Pedersen, B. K. (2003): Glucose ingestion attenuates interleukin-6 release from contracting skeletal muscle in humans. J Physiol, 549: 607-612.
- Henningsen, J., Rigbolt, K. T., Blagoev, B., Pedersen, B. K., & Kratchmarova, I. (2010): Dynamics of the skeletal muscle secretome during myoblast differentiation. Mol Cell Proteomics, 9(11): 2482-2496.
- Jiang, L. Q., Duque-Guimaraes, D. E., Machado, U. F., Zierath, J. R., & Krook, A. (2013): Altered response of skeletal muscle to IL-6 in type 2 diabetic patients. Diabetes, 62(2): 355-361.
- Jiang, L. Q., Franck, N., Egan, B., Sjogren, R. J., Katayama, M., Duque-Guimaraes, D., Arner, P., Zierath, J. R., & Krook, A. (2013): Autocrine role of interleukin-13 on skeletal muscle glucose metabolism in type 2 diabetic patients involves microRNA let-7. Am J Physiol Endocrinol Metab, 305(11): 1359-1366.
- Keller, C., Steensberg, A., Pilegaard, H., Osada, T., Saltin, B., Pedersen, B. K., & Neufer, P. D. (2001): Transcriptional activation of the IL-6 gene in human contracting skeletal muscle: influence of muscle glycogen content. FASEB J, 15(14): 2748-2750.
- Krabbe, K. S., Nielsen, A. R., Krogh-Madsen, R., Plomgaard, P., Rasmussen, P., Erikstrup, C., Fischer, C. P., Lindegaard, B., Petersen, A. M., Taudorf, S., Secher, N. H., Pilegaard, H., Bruunsgaard, H., & Pedersen, B. K. (2007): Brain-derived neurotrophic factor (BDNF) and type 2 diabetes. Diabetologia, 50(2): 431-438.
- Lin, Z., Tian, H., Lam, K. S., Lin, S., Hoo, R. C., Konishi, M., Itoh, N., Wang, Y., Bornstein, S. R., Xu, A., & Li, X. (2013): Adiponectin mediates the metabolic effects of FGF21 on glucose homeostasis and insulin sensitivity in mice. Cell Metab, 17(5): 779-789.
- Matthews, V. B., Astrom, M. B., Chan, M. H., Bruce, C. R., Krabbe, K. S., Prelovsek, O., Akerstrom, T., Yfanti, C., Broholm, C., Mortensen, O. H., Penkowa, M., Hojman, P., Zankari, A., Watt, M. J., Bruunsgaard, H., Pedersen, B. K., & Febbraio, M. A. (2009): Brain-derived neurotrophic factor is produced by skeletal muscle cells in response to contraction and enhances fat oxidation via activation of AMP-activated protein kinase. Diabetologia, 52(7): 1409-1418.
- Nieto-Vazquez, I., Fernandez-Veledo, S., de Alvaro, C., & Lorenzo, M. (2008): Dual role of interleukin-6 in regulating insulin sensitivity in murine skeletal muscle. Diabetes, 57(12): 3211-3221.
- Pedersen, B. K. (2011): Exercise-induced myokines and their role in chronic diseases. Brain Behav Immun, 25(5): 811-816.
- Pérez-López, A. (2014): Miokinas, ¿el músculo un órgano secretor? Recuperado el 31 de Octubre en la Revista Mundo Entrenamiento.
- Plomgaard, P., Hansen, J., Bianda, V., Pedersen, B. K., & Bouzakri, K. (2013): Fractalkine is a novel myokine which protects myotubes from TNF alpha induced insulin resistance. Diabetologia, 56(Suppl 1): 79.
- Quinn, L. S., Anderson, B. G., Strait-Bodey, L., Stroud, A. M., & Argiles, J. M. (2009): Oversecretion of interleukin-15 from skeletal muscle reduces adiposity. Am J Physiol Endocrinol Metab, 296(1): E191-202.
- Quinn, L. S., Strait-Bodey, L., Anderson, B. G., Argiles, J. M., & Havel, P. J. (2005): Interleukin-15 stimulates adiponectin secretion by 3T3-L1 adipocytes: evidence for a skeletal muscle-to-fat signaling pathway. Cell Biol Int, 29(6): 449-457.
- Rasmussen, P., Brassard, P., Adser, H., Pedersen, M. V., Leick, L., Hart, E., Secher, N. H., Pedersen, B. K., & Pilegaard, H. (2009): Evidence for a release of brain-derived neurotrophic factor from the brain during exercise. Exp Physiol, 94(10): 1062-1069.
- Sadagurski, M., Norquay, L., Farhang, J., D’Aquino, K., Copps, K., & White, M. F. (2010): Human IL6 enhances leptin action in mice. Diabetologia, 53(3): 525-535.
- Seale, P., Conroe, H. M., Estall, J., Kajimura, S., Frontini, A., Ishibashi, J., Cohen, P., Cinti, S., & Spiegelman, B. M. (2011): Prdm16 determines the thermogenic program of subcutaneous white adipose tissue in mice. J Clin Invest, 121(1): 96-105.
- Shah, R., Hinkle, C. C., Ferguson, J. F., Mehta, N. N., Li, M., Qu, L., Lu, Y., Putt, M. E., Ahima, R. S., & Reilly, M. P. (2011): Fractalkine is a novel human adipochemokine associated with type 2 diabetes. Diabetes, 60(5): 1512-1518.
- Stanya, K. J., Jacobi, D., Liu, S., Bhargava, P., Dai, L., Gangl, M. R., Inouye, K., Barlow, J. L., Ji, Y., Mizgerd, J. P., Qi, L., Shi, H., McKenzie, A. N., & Lee, C. H. (2013): Direct control of hepatic glucose production by interleukin-13 in mice. J Clin Invest, 123(1): 261-271.
- Steensberg, A., Febbraio, M. A., Osada, T., Schjerling, P., van Hall, G., Saltin, B., & Pedersen, B. K. (2001): Interleukin-6 production in contracting human skeletal muscle is influenced by pre-exercise muscle glycogen content. J Physiol, 537(Pt 2): 633-639.
- Steensberg, A., van Hall, G., Osada, T., Sacchetti, M., Saltin, B., & Klarlund Pedersen, B. (2000): roduction of interleukin-6 in contracting human skeletal muscles can account for the exercise-induced increase in plasma interleukin-6. J Physiol, 529: 237-242.
- Ueda, S. Y., Yoshikawa, T., Katsura, Y., Usui, T., Nakao, H., & Fujimoto, S. (2009): Changes in gut hormone levels and negative energy balance during aerobic exercise in obese young males. J Endocrinol, 201(1): 151-159.
- van Hall, G., Steensberg, A., Sacchetti, M., Fischer, C., Keller, C., Schjerling, P., Hiscock, N., Moller, K., Saltin, B., Febbraio, M. A., & Pedersen, B. K. (2003): Interleukin-6 stimulates lipolysis and fat oxidation in humans. J Clin Endocrinol Metab, 88(7): 3005-3010.
- Wolsk, E., Mygind, H., Grondahl, T. S., Pedersen, B. K., & van Hall, G. (2010): IL-6 selectively stimulates fat metabolism in human skeletal muscle. Am J Physiol Endocrinol Metab, 299(5): 832-840.
- Xu, X., Ying, Z., Cai, M., Xu, Z., Li, Y., Jiang, S. Y., Tzan, K., Wang, A., Parthasarathy, S., He, G., Rajagopalan, S., & Sun, Q. (2011): Exercise ameliorates high-fat diet-induced metabolic and vascular dysfunction, and increases adipocyte progenitor cell population in brown adipose tissue. Am J Physiol Regul Integr Comp Physiol, 300(5): 1115-1125.
- Zingaretti, M. C., Crosta, F., Vitali, A., Guerrieri, M., Frontini, A., Cannon, B., Nedergaard, J., & Cinti, S. (2009): The presence of UCP1 demonstrates that metabolically active adipose tissue in the neck of adult humans truly represents brown adipose tissue. FASEB J, 23(9): 3113-3120.
- Bernecker, C., Scherr, J., Schinner, S., Braun, S., Scherbaum, W. A., & Halle, M. (2013). Evidence for an exercise induced increase of TNF-alpha and IL-6 in marathon runners. Scand J Med Sci Sports, 23(2), 207-214.
- Chan, M. H., McGee, S. L., Watt, M. J., Hargreaves, M., & Febbraio, M. A. (2004). Altering dietary nutrient intake that reduces glycogen content leads to phosphorylation of nuclear p38 MAP kinase in human skeletal muscle: association with IL-6 gene transcription during contraction. FASEB J, 18(14), 1785-1787.
- Christiansen, T., Paulsen, S. K., Bruun, J. M., Pedersen, S. B., & Richelsen, B. (2010). Exercise training versus diet-induced weight-loss on metabolic risk factors and inflammatory markers in obese subjects: a 12-week randomized intervention study. Am J Physiol Endocrinol Metab, 298(4), E824-831.
- Dandona, P., Aljada, A., & Bandyopadhyay, A. (2004). Inflammation: the link between insulin resistance, obesity and diabetes. Trends Immunol, 25(1), 4-7.
- Dinarello, C. A. (2000). The role of the interleukin-1-receptor antagonist in blocking inflammation mediated by interleukin-1. N Engl J Med, 343(10), 732-734.
- Donges, C. E., Duffield, R., & Drinkwater, E. J. (2010). Effects of resistance or aerobic exercise training on interleukin-6, C-reactive protein, and body composition. Med Sci Sports Exerc, 42(2), 304-313.
- Drummond, M. J., Timmerman, K. L., Markofski, M. M., Walker, D. K., Dickinson, J. M., Jamaluddin, M., Brasier, A. R., Rasmussen, B. B., & Volpi, E. (2013). Short-term bed rest increases TLR4 and IL-6 expression in skeletal muscle of older adults. Am J Physiol Regul Integr Comp Physiol, 305(3), R216-223.
- Duncan, B. B., Schmidt, M. I., Pankow, J. S., Ballantyne, C. M., Couper, D., Vigo, A., Hoogeveen, R., Folsom, A. R., Heiss, G., & Atherosclerosis Risk in Communities, Study. (2003). Low-grade systemic inflammation and the development of type 2 diabetes: the atherosclerosis risk in communities study. Diabetes, 52(7), 1799-1805.
- Eckardt, K., Gorgens, S. W., Raschke, S., & Eckel, J. (2014). Myokines in insulin resistance and type 2 diabetes. Diabetologia, 57(6), 1087-1099.
- Fischer, C. P., Berntsen, A., Perstrup, L. B., Eskildsen, P., & Pedersen, B. K. (2007). Plasma levels of interleukin-6 and C-reactive protein are associated with physical inactivity independent of obesity. Scand J Med Sci Sports, 17(5), 580-587.
- Gleeson, M. (2007). Immune function in sport and exercise. J Appl Physiol (1985), 103(2), 693-699.
- Gorgens, S. W., Eckardt, K., Elsen, M., Tennagels, N., & Eckel, J. (2014). Chitinase-3-like protein 1 protects skeletal muscle from TNFalpha-induced inflammation and insulin resistance. Biochem J, 459(3), 479-488.
- Gorgens, S. W., Raschke, S., Holven, K. B., Jensen, J., Eckardt, K., & Eckel, J. (2013). Regulation of follistatin-like protein 1 expression and secretion in primary human skeletal muscle cells. Arch Physiol Biochem, 119(2), 75-80.
- Im, S. H., & Rao, A. (2004). Activation and deactivation of gene expression by Ca2+/calcineurin-NFAT-mediated signaling. Mol Cells, 18(1), 1-9.
- Kern, P. A., Ranganathan, S., Li, C., Wood, L., & Ranganathan, G. (2001). Adipose tissue tumor necrosis factor and interleukin-6 expression in human obesity and insulin resistance. Am J Physiol Endocrinol Metab, 280(5), E745-751.
- King, D. E., Carek, P., Mainous, A. G., 3rd, & Pearson, W. S. (2003). Inflammatory markers and exercise: differences related to exercise type. Med Sci Sports Exerc, 35(4), 575-581.
- Lambernd, S., Taube, A., Schober, A., Platzbecker, B., Gorgens, S. W., Schlich, R., Jeruschke, K., Weiss, J., Eckardt, K., & Eckel, J. (2012). Contractile activity of human skeletal muscle cells prevents insulin resistance by inhibiting pro-inflammatory signalling pathways. Diabetologia, 55(4), 1128-1139.
- Nielsen, A. R., Erikstrup, C., Johansen, J. S., Fischer, C. P., Plomgaard, P., Krogh-Madsen, R., Taudorf, S., Lindegaard, B., & Pedersen, B. K. (2008). Plasma YKL-40: a BMI-independent marker of type 2 diabetes. Diabetes, 57(11), 3078-3082.
- Ober, C., Tan, Z., Sun, Y., Possick, J. D., Pan, L., Nicolae, R., Radford, S., Parry, R. R., Heinzmann, A., Deichmann, K. A., Lester, L. A., Gern, J. E., Lemanske, R. F., Jr., Nicolae, D. L., Elias, J. A., & Chupp, G. L. (2008). Effect of variation in CHI3L1 on serum YKL-40 level, risk of asthma, and lung function. N Engl J Med, 358(16), 1682-1691.
- Ostrowski, K., Rohde, T., Asp, S., Schjerling, P., & Pedersen, B. K. (1999). Pro- and anti-inflammatory cytokine balance in strenuous exercise in humans. J Physiol, 515 ( Pt 1), 287-291.
- Ouchi, N., Oshima, Y., Ohashi, K., Higuchi, A., Ikegami, C., Izumiya, Y., & Walsh, K. (2008). Follistatin-like 1, a secreted muscle protein, promotes endothelial cell function and revascularization in ischemic tissue through a nitric-oxide synthase-dependent mechanism. J Biol Chem, 283(47), 32802-32811.
- Paulsen, G., Mikkelsen, U. R., Raastad, T., & Peake, J. M. (2012). Leucocytes, cytokines and satellite cells: what role do they play in muscle damage and regeneration following eccentric exercise? Exerc Immunol Rev, 18, 42-97.
- Pedersen, B. K., Akerstrom, T. C., Nielsen, A. R., & Fischer, C. P. (2007). Role of myokines in exercise and metabolism. J Appl Physiol (1985), 103(3), 1093-1098.
- Pedersen, B. K., & Febbraio, M. A. (2008). Muscle as an endocrine organ: focus on muscle-derived interleukin-6. Physiol Rev, 88(4), 1379-1406.
- Pedersen, B. K., & Saltin, B. (2006). Evidence for prescribing exercise as therapy in chronic disease. Scand J Med Sci Sports, 16 Suppl 1, 3-63.
- Petersen, A. M., & Pedersen, B. K. (2005). The anti-inflammatory effect of exercise. J Appl Physiol (1985), 98(4), 1154-1162.
- Plomgaard, P., Hansen, J., Bianda, V., Pedersen, B. K., & Bouzakri, K. (2013). Fractalkine is a novel myokine which protects myotubes from TNF alpha induced insulin resistance. Diabetologia, 56(Suppl 1), S79 (Abstract 178).
- Sell, H., Habich, C., & Eckel, J. (2012). Adaptive immunity in obesity and insulin resistance. Nat Rev Endocrinol, 8(12), 709-716.
- Shah, R., Hinkle, C. C., Ferguson, J. F., Mehta, N. N., Li, M., Qu, L., Lu, Y., Putt, M. E., Ahima, R. S., & Reilly, M. P. (2011). Fractalkine is a novel human adipochemokine associated with type 2 diabetes. Diabetes, 60(5), 1512-1518.
- Starkie, R., Ostrowski, S. R., Jauffred, S., Febbraio, M., & Pedersen, B. K. (2003). Exercise and IL-6 infusion inhibit endotoxin-induced TNF-alpha production in humans. FASEB J, 17(8), 884-886.
- Whitham, M., Chan, M. H., Pal, M., Matthews, V. B., Prelovsek, O., Lunke, S., El-Osta, A., Broenneke, H., Alber, J., Bruning, J. C., Wunderlich, F. T., Lancaster, G. I., & Febbraio, M. A. (2012). Contraction-induced interleukin-6 gene transcription in skeletal muscle is regulated by c-Jun terminal kinase/activator protein-1. J Biol Chem, 287(14), 10771-10779.



Feliz de leerlos,
muy didáctico, claro, fácil y muy interesante.
Muchas Gracias,